Hexokinasstrukturer, funktioner, former
- 1272
- 186
- Prof. Erik Johansson
De Hexokinas (HK) är enzymet som katalyserar den första reaktionen av den glykolytiska vägen praktiskt taget i alla levande organismer, både i prokaryoter och i eukaryoter. Det ansvarar för överföringen av en fosforylgrupp mot glukos, vilket producerar glukos-6p, även om den också kan fosforylera andra hexösa sockerarter (av 6 kolatomer).
Detta enzym klassificeras inom en av de två familjerna med glukos -kinasenzymer (enzymer som överför fosforylgrupper till substrat som glukos): Hexoquinase -familjen (HK), vars medlemmar delas upp i tre olika grupper kända som HK -gruppen, The Hex Grupp A och grupp B.
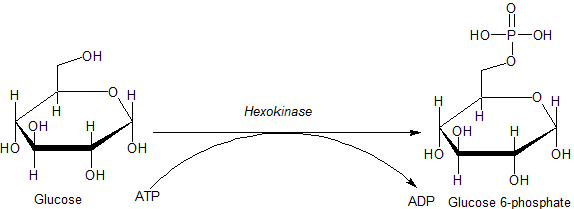
 Reaktion katalyserad av hexokinasenzymet (källa: JMUN7616 [Public Domain] via Wikimedia Commons)
Reaktion katalyserad av hexokinasenzymet (källa: JMUN7616 [Public Domain] via Wikimedia Commons) Enzymerna som tillhör HK -familjen kännetecknas av glukosfosforylering på bekostnad av ATP som en fosforylgruppsdonatormolekyl, och medlemmarna i samma skiljer sig från varandra huvudsakligen med avseende på deras molekylvikt och substratspecificitet.
HK-gruppen tillhör enzymerna av eukaryota organismer (ATP: D-Hexose 6-Fosfotransferaser), under tiden representeras grupp A av enzymerna från Gram-negativa bakterier, cyanobakterier, amithocondred och tripanosomatidalprotister och grupp B KONNAKTERARE ENAZYMENSER -Spositiva bakterier och Creanarqueotas -organismer.
Enzymerna av grupper A och B är också kända som glycoquinases (GLCKS), eftersom de kan uteslutande glukosfosforylering, varför dessa enzymer kallas ATP: D-glukos 6-Fosfotransferaser.
Som glykolytiskt enzym har hexokinas stor metabolisk betydelse, eftersom utan den här viktiga vägen inte skulle vara möjlig och cellerna som är mycket beroende av kolhydratförbrukning, såsom till exempel hjärn- och muskelceller hos många däggdjur, skulle ha allvarliga funktionella och fysiologiska hinder i allmänhet.
[TOC]
Strukturera
Som framgår senare finns det i däggdjur och andra ryggradsdjur (liksom i encelliga organismer som jäst) olika typer av hexokinasenzymer. Hos däggdjur har fyra beskrivits: isoformer I, II, III och IV.
Kan tjäna dig: järnlegeringar: egenskaper, typer, exempelDe tre första isoenzymerna har 100 kDa molekylvikt, men isoenzymet IV har 50 kDa. Dessa isoenzymer (särskilt I-III) uppvisar hög likhet mellan sekvensen mellan dem med avseende på deras C- och N-terminala ändar, liksom andra medlemmar i hexokinasfamiljen.
Den N-terminala domänen för dessa enzymer anses vara "regulator" -domänen, medan katalytisk aktivitet utförs av den C-terminala domänen (HK II för däggdjur har aktiva platser inom båda domänerna).
Den N-terminala domänen är kopplad till den C-terminala domänen genom en alfa-propeller, var och en har cirka 50 kDa molekylvikt och har en korsning för glukos.
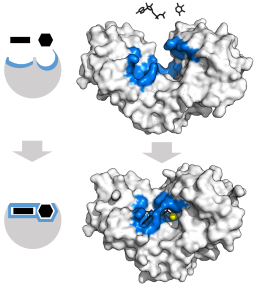 Inducerad justeringsmodell för hexokinasenzymet (med avseende på dess två underlag: ATP och glukos) (Källa: Thomas Shafee [CC av 4.0 (https: // CreativeCommons.Org/licenser/av/4.0)] via Wikimedia Commons)
Inducerad justeringsmodell för hexokinasenzymet (med avseende på dess två underlag: ATP och glukos) (Källa: Thomas Shafee [CC av 4.0 (https: // CreativeCommons.Org/licenser/av/4.0)] via Wikimedia Commons) Den tertiära strukturen för dessa enzymer består i huvudsak av p-placerade ark blandade med alfa-propeller, vars andel varierar med avseende på enzymet och den aktuella arten; Unionens ställe för ATP, det andra hexokinas -substratet, består vanligtvis av fem park och två alfa -propeller.
Funktioner
Hexokinas har en transcendental funktion i kolhydratmetabolismen hos de flesta levande varelser, eftersom katalyserar det första steget i den glykolytiska vägen och medför fosforylering av glukos inuti.
Detta första steg av glykolys, som består av överföring av en fosforylgrupp från ATP (givare) till glukos, vilket ger 6-fosfat och ADP-glukos, är den första av de två energiinvesteringsstegen i form av ATP.
Dessutom är reaktionen katalyserad av hexokinas passagen av "aktivering" av glukos för efterföljande bearbetning och representerar ett steg av "engagemang", eftersom glukos således fosforylerad inte kan lämna cellen genom dess konventionella transportörer i membranplasma.
Kan tjäna dig: heterogena blandningarProdukten från reaktionen katalyserad av hexokinas, det vill säga 6-fosfatglukoset, är en grenpunkt, eftersom den är det första underlaget som används på pentosfosfatets väg och i syntesen av glykogen i många djur (och av stärkelse på växter).
I växter
Funktionen av hexokinas i växter skiljer sig inte så mycket från djur eller mikroorganismer, men i de övre växterna fungerar detta enzym också som en "sensor" av sockerkoncentration.
Betydelsen av denna funktion i dessa organismer har att göra med deltagande av sockerarter som regleringsfaktorer i uttrycket av gener som är involverade i olika metaboliska processer som:
- Fotosyntes
- Glioxylatcykeln
- Andningen
- Nedbrytning eller syntes av stärkelse och sackaros
- Kvävemetabolism
- Försvaret mot patogener
- Cellcykelreglering
- Läkningssvaret
- Pyping
- Senescens, bland andra.
Denna funktion av hexokinas som en "sensor" av mängden intracellulär glukos har också beskrivits för jäst och däggdjur.
Former
I naturen finns det olika former av hexokinaser och detta beror på grund av de arter som beaktas.
Hos människa och andra ryggradsdjur, till exempel, har förekomsten av fyra olika isoformer av hexokinasenzymet i det cytosoliska facket visats, till vilket det har betecknats med det romerska antalet I, II, III och IV.
Isoenzymer, II och III är 100 kDa molekylvikt, hämmas av deras reaktionsprodukt (6-fosfat glukos) och är mycket relaterade till glukos, det vill säga de har en mycket låg km-konstant. Dessa enzymer har emellertid liten specificitet av substrat, att kunna fosforylera andra hexosor såsom fruktos och hand.
Kan tjäna dig: syror: egenskaper och exempelIsoenzymet IV, även känt som glycoquinase (GLCK), har endast 50 kDa molekylvikt och har, trots att de är lite relaterade (höga km -värden), en hög specificitet genom glukos som underlag och är inte underkastade dem regleringsmekanismer som den andra som den andra tre isoenzymer.
Glukokinas (isoenzym IV av hexokinas av många däggdjur) finns huvudsakligen i levern och hjälper detta organ i "justering" av dess glukosförbrukningshastighet som svar på variationerna i detta underlag i det cirkulerande blodet.
De tre generna som kodar för hexokinaser I, II och III hos djur verkar endast iii bosatt vid den C-terminala änden.
Referenser
- Aronoff, s. L., Berkowitz, K., Shreiner, b., & Vill, L. (2004). Glukosmetabolism och reglering: bortom insulin och glukagon. Spektrumdiabetes, 17(3), 183-190.
- Harrington, g. N., & Bush, D. R. (2003). Hexokinasens bifuncionala roll i metabolism och glukosignalering. Växtcellen, femton(11), 2493-2496.
- Jang, j. C., León, s., Zhou, L., & Sheen, J. (1997). Hexokinas vad gäller sockersensor i högre växter. Växtcellen, 9(1), 5-19.
- Kawai, s., Mukai, t., Mori, s., Mikami, f., & Murata, K. (2005). Hypotes: Strukturer, evolution och förfader till glukoskinaser i familjen hexokinas. Journal of Bioscience and Bioengineering, 99(4), 320-330.
- Mathews, K. OCH. (1998). Skåpbil. Biokemi.
- Wilson, J. OCH. (2003). Isozymer av däggdjurshexokinas: struktur, subcellulär lokalisering och metabolisk funktion. Journal of Experimental Biology, 206(12), 2049-2057.

