Alifatiska kolvätenegenskaper, nomenklatur, reaktioner, typer

- 4925
- 870
- Anders Svensson
De Alifatiska kolväten De är alla de som saknar aromatisitet, inte i luktande mening, utan när det gäller kemisk stabilitet. Klassificering av kolväten på detta sätt är idag för tvetydigt och opriktigt, eftersom det inte diskriminerar mellan olika typer av kolväten som inte är aromatiska.
Således har vi alifatiska kolväten och aromatiska kolväten. De senare erkänns av sin grundenhet: Benncénico -ringen. De andra kan å andra sidan anta vilken molekylär struktur som helst: linjär, grenad, cyklisk, omättad, polycyklisk; Så länge de inte har konjugerade system som bensen.
 Tändarnas flytande bränsle består av en blandning av alifatiska kolväten. Källa: Pixnio.
Tändarnas flytande bränsle består av en blandning av alifatiska kolväten. Källa: Pixnio. Termen "alifatisk" föddes från det grekiska ordet "aliphar", som betyder fett, används också för att hänvisa till oljor. Därför tilldelades denna klassificering under 1800 -talet till de kolväten som erhölls från de oljiga extrakten; Medan aromatiska kolväten extraherades från träd och doftande hartser.
Som grunden för organisk kemi konsoliderad upptäcktes emellertid att det fanns en kemisk egenskap som differentierade kolväten, ännu viktigare än deras naturliga källor: aromatisk (och inte doft).
På detta sätt upphörde alifatiska kolväten att endast vara de som erhållits från fetter, för att vara alla som saknar aromatiskhet. Inom denna familj har vi alkener och alkyner, oavsett om de är linjära eller cykliska. Det är därför "alifatiskt" anses vara felaktigt; Även om det är användbart för att hantera vissa allmänna aspekter.
Till exempel när det sägs "extremer" eller "kedjor" alifatiska, molekylära regioner hänvisas till var aromatiska ringar är frånvarande. Av alla alifatiska kolväten är den enklaste per definition metan, Cho4; Medan bensen är den enklaste av aromatiska kolväten.
[TOC]
Egenskaper hos alifatiska kolväten
Egenskaperna hos alifatiska kolväten oscillerar i olika grader beroende på vilka som beaktas. Det finns låga och höga molekylmassor, såväl som linjära, grenade, cykliska eller polycykliska, även de med fantastiska tre dimensionella strukturer; Som med kubanen, i form av en kub.
Det finns dock vissa generaliteter som kan nämnas. De flesta alifatiska kolväten är hydrofoba och apolära gaser eller vätskor, med lite mer apolära än andra, eftersom även de i vars kolkedjor har halogen, syre, kväve eller svavelatomer ingår i listan.
Kan tjäna dig: Bor: historia, egenskaper, struktur, användningarDe är också brandfarliga föreningar, eftersom de är mottagliga för oxidation i luften före en minsta värmekälla. Denna funktion blir farligare om vi lägger till dess höga volatilitet på grund av de svaga spridande interaktioner som upprätthåller alifatiska molekyler sammanhängande.
Till exempel ser vi det i butanen, en gas som kan kondenseras med relativt enkelhet som propan. Båda är mycket flyktiga och brandfarliga, så de är aktiva komponenter i köksgas eller fickbeläggare.
Naturligtvis tenderar sådan volatilitet att minska när molekylmassan och kolvätet orsakar mer och mer viskösa vätskor.
Nomenklatur
Nomenklaturen för kolväten skiljer sig ännu mer än dess egenskaper. Om de är alko eller alkiner följs samma standarder som anges av IUPAC: Välj den längsta kedjan och tilldela de lägsta indikatorerna till det mest ersatta slutet eller till heteroatomerna eller mer reaktiva grupper.
På detta sätt vet du på vilket kol varje substituent hittas, eller till och med omättnad (dubbla eller trippellänkar). När det gäller cykliska kolväten föregås namnet av de substituenter som anges i alfabetisk ordning, följt av ordet "cykel", räknar kolnumren som integrerar det.
Tänk till exempel på följande två cyklohexaner:
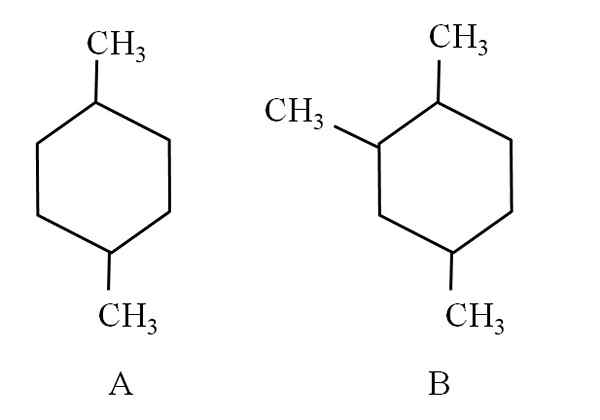 Två cyklohexaner, som klassificeras som alifatiska kolväten. Källa: Gabriel Bolívar.
Två cyklohexaner, som klassificeras som alifatiska kolväten. Källa: Gabriel Bolívar. Cyclohexan A, kallas 1,4-dimetylciclohexan. Om ringen var fem kol, skulle den vara 1,4-dimetylciclopentano. Samtidigt kallas cyklohexan B 1,2,4-trimetylcyklohexan och inte 1,4,6-cyklohexan, som den försöker använda de lägsta indikatorerna.
Nu kan nomenklaturen bli mycket komplicerad för operabotiska strukturer kolväten. För dem finns det mer specifika regler, som måste förklaras separat och noggrant; Liksom med målen, terpener, policyer och polycykliska föreningar.
Reaktioner
Förbränning
Lyckligtvis är reaktionerna mindre varierande för dessa kolväten. En av dem nämndes redan: de förbräner lätt och producerar koldioxid och vatten, utöver andra oxider eller gaser beroende på närvaron av heteroatomer (Cl, N, P, O, etc.). Men CO2 och h2Eller är de viktigaste förbränningsprodukterna.
Tillägg
Om de har omättning kan de drabbas av tilläggsreaktioner; Det vill säga de integrerar små molekyler i sitt skelett som substituenter efter en specifik mekanism. Bland dessa molekyler har vi vatten, väte och halogener (f2, Kli2, Bras2 och jag2).
Halogenering
Å andra sidan alifatiska kolväten under förekomsten av ultraviolett strålning (Hv) och värme kan bryta C-H-länkar för att ändra dem med C-X-länkar (C-F, C-Cl, etc.). Detta är halogeneringsreaktionen, som observeras i mycket korta kedjor alkaner, såsom metan eller pentan.
Kan tjäna dig: Nitriter: Egenskaper, struktur, nomenklatur, bildningCraqueo
En annan reaktion som alifatiska kolväten kan drabbas, särskilt långkedjiga alkaner, är termisk sprickor. Den består av tillförsel av intensiv värme så att den termiska energin bryter C-C-bindningarna, och därmed små molekyler, mer citerade på bränslemarknaden, från stora molekyler bildas.
De fyra reaktionerna ovan är de viktigaste som kan drabbas av ett alifatiskt kolväte, förbränningen är den viktigaste av alla, eftersom den inte diskriminerar någon förening; Alla kommer att brinna i närvaro av syre, men inte alla kommer att lägga till molekyler eller bryta i små molekyler.
Grabbar
Alifatiska kolvätengruppen är oändliga föreningar, som i sin tur klassificeras mer specifika, vilket indikerar graden av deras omättning, liksom den typ av struktur de har.
Enligt hur omättade de är, har vi alkanerna (mättade), alkener och alkyner (omättade).
Alkanerna kännetecknas av att ha enkla C-C-länkar, medan vi i alkener och alkiner observerar länkar C = C respektive C≡C. Ett mycket allmänt sätt att visualisera dem är att tänka på kolskeletten i alkanerna som sickzagen och vikta kedjor, vara "fyrkantiga" för alkener och "raka linjer" för alkiner.
Detta beror på att de dubbla och trippelbindningarna har energi och stenrisk begränsning i deras rotationer, "härdar" deras strukturer.
Alkitos och alkiner kan grenas, cykliska eller polycykliska. Det är därför cykloalcanos, cykloalquenos, cykloalquinos och föreningar såsom decalin (cykelstruktur), Adamantano (liknande en baseballmössa), heptalen, gonano, bland andra, alifatiska kolväten anses också betraktas som.
Från alkener uppstår andra typer av kolväten, såsom målen (med två dubbelbindningar), polieniska (med många dubbla alternativa bindningar) och terpener (föreningar härrörande från isopren, en dien).
Ansökningar
Återigen kan användningar för dessa kolväten variera beroende på vilken som övervägs. Men i sektionerna av egenskaper och reaktioner klargjordes det att all förbränning, inte bara för att frigöra gasmolekyler, utan också lätt och värme. Således är de energibehållare, användbara för att tjäna som bränslen eller värmekällor.
Det är därför de används som en del av sammansättningen av bensin, för naturgas, i Bunsen -tändare och i allmänhet för att kunna komma från eld.
Kan tjäna dig: oktetregelEtt av de mest anmärkningsvärda exemplen är det för acetylen, HC≡CH, vars förbränning gör det möjligt att locka metalljonerna av ett prov i atomabsorptionsspektrometri som utförs på analytiska tester. På samma sätt kan den resulterande elden användas för svetsar.
Flytande alifatiska kolväten, såsom paraffinik, används ofta som fettuttagslösningsmedel. Dessutom kan dess lösningsmedelsverkan användas för att ta bort fläckar, emaljer, målningar eller helt enkelt för att förbereda lösningar av en specifik organisk förening.
Den största molekylmassan, som redan är viskös eller solid, är avsedda för utarbetande av hartser, polymerer eller mediciner.
När det gäller termen "alifatisk" används det vanligtvis för att hänvisa till dessa regioner, i en makromolekyl, som saknar aromatiskhet. Till exempel beskrivs asfaltens ytligt som en aromatisk kärna med alifatiska kedjor.
Exempel
Först sades det att metan är den enklaste av alifatiska kolväten. De följs av propan, cho3Ch2Ch3, Butano, ch3Ch2Ch2Ch3, Pentano, ch3Ch2Ch2Ch2Ch3, Octane, Nonano, Dean och så vidare, med allt mer långa alkaner.
Detsamma gäller för eten, Cho2= Ch2, Propen, ch3Ch = ch2, Buteno, ch3Ch2Ch = ch3, Och för resten av alkinerna. Om det finns två dubbelbindningar är de Oley, och om det finns mer än två, Polienas. På samma sätt kan det finnas dubbla och trippelförbindelser i samma skelett, vilket ökar strukturell komplexitet.
Bland cykloalcanos kan vi nämna cyklopropan, cyklobutan, cyklopentano, cyklohexan, cykloheptano, cyklooctan, samt cyklohexen och cyklohexin. Från alla dessa kolväten erhålls grenade derivat, vilket ytterligare multiplicerar de tillgängliga exemplen (såsom 1,4-dimetylciclohexano).
Av de mest representativa terpenerna har vi limonen, mentol, pinen, vitamin A, escualeno, etc. Polyeten är en mättad polymer med enheter -ch2-Ch2-, Så det är också ett exempel på dessa kolväten. Andra exempel har redan citerats i föregående avsnitt.
Referenser
- Morrison, r. T. och Boyd, R, N. (1987). Organisk kemi. Femte upplagan. Redaktör Addison-Wesley Inter-American.
- Carey f. (2008). Organisk kemi. (Sjätte upplagan). MC Graw Hill.
- Graham solomons t.W., Craig b. Fryhle. (2011). Organisk kemi. Aminer. (10: e upplagan.). Wiley Plus.
- Helmestine, Anne Marie, PH.D. (22 augusti 2019). Alifatisk kolväte definition. Återhämtat sig från: tankco.com
- Wikipedia. (2019). Alifatisk förening. Hämtad från: i.Wikipedia.org
- Kemi librettexts. (20 augusti 2019). Alifatiska kolväten. Återhämtad från: kem.Librettexts.org
- Elizabeth Wyman. (2019). Alifatiska kolväten: Definition & egenskaper. Studie. Återhämtat sig från: studie.com

