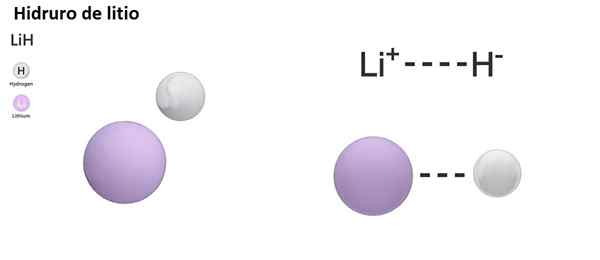Hydrare
- 873
- 32
- Per Karlsson
Vad är hydruros?
Hydros är kemiska föreningar som är resultatet av reaktionen av väte med metallelement (natrium, kalium, kalcium, etc.) och inte metaller (klor, fluor, syre, kväve, kol, etc.). Väte reagerar med nästan alla kemiska element, så hydror är mycket olika ämnen.
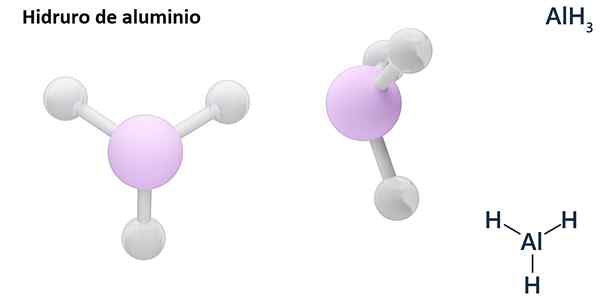
Dess allmänna formler kan vara MH -typenn, Där m är metall och n dess Valencia (+1, +2, +3), såsom aluminiumhydrid, ALH3; eller av EH -typenn eller hnOch där E är ett icke -metalliskt element och n Dess Valencia, som NH3 eller h2S.
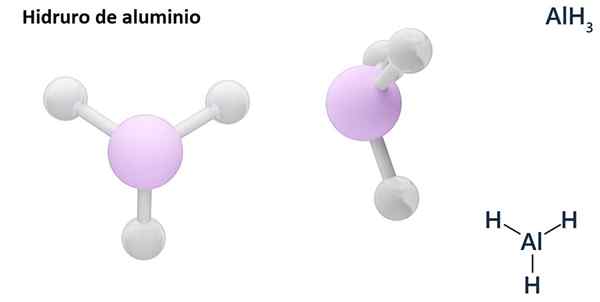
Hydros är vanligtvis binära föreningar, det vill säga de är resultatet av kombinationen av väte med ett annat kemiskt element. Väte kan emellertid också etablera kombinationer med flera kemiska element för att bilda mer komplexa hydrorer. Alla hydrorer förklaras kommer att vara binära, till exempel ALH3 och nah.
Det finns tre typer av hydrorer enligt arten av dess kemiska bindning: joniska, molekylära och metalliska. Joniska eller saltlösningshydror kännetecknas av närvaron av en jonisk bindning. Denna länk består av den elektriska attraktionen mellan den positiva belastningen av en alkalisk metall (NA+) eller alkalisk bunt (mg2+) och den negativa belastningen av hydridanjon (h-).
Molekylära hydrider, å andra sidan, kännetecknas av bildandet av en kovalent bindning mellan väte och ett icke -metalliskt element. Bland de icke -metalliska elementen som bildar hydros är: klor, brom, fluor, jod, syre och kväve.
Och metallhydror är resultatet av kombinationen av väte med vissa övergångsmetaller. Denna typ av hydrider, till skillnad från de tidigare, har komplexa strukturer och kommer inte att förklaras här.
Hydrosegenskaper
Hydrunns egenskaper varierar beroende på typen av hydrid: joniska, molekylära eller metalliska, så deras egenskaper måste anges separat.
Joniska eller saltlösningar
De är kristallina vita fasta ämnen, men på grund av närvaron av föroreningar får de en gråaktig färg. Dessa hydrider är inte lösliga i vanliga lösningsmedel, såsom vatten, alkohol, etc. De har också höga kokande och fusionspunkter.
De har en hög och smält tillståndstäthet kan utföra elektricitet.
Joniska hydurns betraktas som basiska eller alkaliska, eftersom de är upplösta i vattenform av hydroxider och frisätter molekylväte:
Nah +h2O → h2 + Naoh
Reaktionen av den joniska hydriden med vatten är mycket kraftfull och farlig: den producerar väte i en gasform, vilket är ett brännbart och brandfarligt material.
Joniska hydurns kan också reagera med metallhalider, bildade av en metall och en icke -metall känd som halogen (MX, x = f, cl, br, i):
Kan tjäna dig: dimetylanylin: struktur, egenskaper, syntes, användning4 lih +alcl3 → Lialh4 + 3 LICL
LiH (litiumhydrid) är en binär förening; Medan lialh4 (Litium och aluminiumhydrid) är en ternär förening, det vill säga den består av tre kemiska element.
Molekylära eller kovalenta hydroser
De är i vätska eller gasformigt tillstånd till skillnad från joniska hydrorer, som är solida. De har låga kokning och fusionspunkter och observerar att kokpunkten i hydrid genom att öka hydridens molekylvikt; Förutom ammoniak (NH3), Vatten (h2O) och fluoridhydrid (HF).
Kovalenta hydrider är dåliga elektricitetsledare och många av deras egenskaper beror på bildandet av vätebroar. Kovalenta hydrider betraktas som syror, eftersom upplösta i vatten kan orsaka syror, till exempel saltsyra.
Metallhydror
De är i fast tillstånd och presenterar den mörka tonen i metaller. De är bra elektricitetsledare och har glansiga ytor. Metalliska hydrider som är stabila i luften blir reagens när de värms upp, till exempel uranhydrid (UH3) Presentera den här egenskapen.
Nomenklatur
Sättet att namnge hydrorer är enkelt och varierar inte för mycket i någon av nomenklaturerna. Om den metalliska metallen eller elementet har mer än en valens anges den i parentes och med romerskt antal enligt aktie nomenklaturen.
Till exempel Feh3 kallas järnhydrid (III) och COH2 Kobolthydro (ii). Samma hydrider kan också utses med den systematiska nomenklaturen, som använder sig av de grekiska siffrorna (DI, TRI, TETRA, etc.). Således feh3 kallas järn trihydrid och coh2 koboltdihydruro.
Den klassiska nomenklaturen används inte i stor utsträckning för hydros. Till exempel är NAH mer känd som natriumhydrid och inte natriumhydrid.
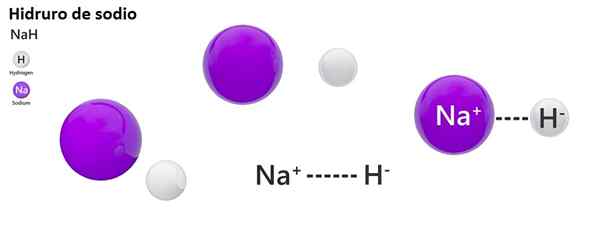 Natriumhydrid
Natriumhydrid Hur bildas hydros?
Joniska eller saltlösningar
De bildas av reaktionen av väte med en metall som tillhör gruppen av alkaliska metaller eller gruppen av alkaliska-terrero-metaller.
I hydrorer tränade med dessa metaller finns väte i H -formen-, känd som hydridanjon.
Alkaliska metaller (litium, natrium, kalium, rubidium och cesium) reagerar med väte för att bilda deras motsvarande hydurns:
2 m (l)+h2(g) → 2mh (s)
Kan tjäna dig: enhetsoperationerMetall m vid reagering är i flytande tillstånd och väte i gasformigt tillstånd, så reaktionen kräver höga temperaturer och högt tryck. Tänk på följande exempel:
2 li (l) +h2 (g) → 2 lih (er)
Reaktionen av väte med alkaliska tredje metaller (beryllium, magnesium, kalcium, strontium och barium), för hydridbildning, liknar den som observerats med alkaliska metaller.
Magnesium och beryllium bildar hydrider, men deras bindningar med väte är av kovalenta typ; Det vill säga icke -jionisk, till skillnad från andra alkaliska metaller:
Ca (l) +h2 (g) → CAH2 (S)
Molekylär hydrorer
Väte kan reagera med icke -metaller, motsvarande grupper 14, 15, 16 och 17 i periodiska tabellen, för att bilda molekylära hydrorer. Tänk till exempel på bildningen av fluoridhydrid genom kombination eller direkt blandning av väte med fluor:
H2 (g) +f2 (g) → 2 HF (g)
HF är mer känd som vätefluorid, men det kallas också fluoridhydrid.
Väte kan också reagera med syre (grupp 16 i det periodiska tabellen) efter samma schema:
2 h2 (g) +eller2 (g) → 2 h2O (g)
Reaktionen kräver värmeförsörjning för att producera väteoxid (vatten) eller syrehydrid.
Väte kan också reagera med kväve, som tillhör grupp 15 i den periodiska tabellen för att bilda kvävehydid, bättre känd som ammoniak (NH3).
N2 (g) +3 h2 (g) → 2 NH3 (g)
Reaktionen kräver värmeförsörjning, högt tryck och närvaron av katalysatorer (de påskyndar kemiska reaktioner).
Metallhydror
De bildas av reaktionen av övergångsmetaller (grupper 3, 4, 5, 6, 10, 11 och 12 i periodiska tabellen) med väte. Övergångsmetaller i grupperna 7, 8 och 9 bildar emellertid inte föreningar med väte, ett fenomen som kallas hydridgap eller gaphydrid.
Ett unikt kännetecken för övergångsmetaller hydrorer är att de inte alltid presenterar en fast proportion mellan antalet väteatomer och antalet atomer närvarande i hydrid. Det vill säga deras formler och strukturer är inte enkla att representera.
Användning/applikationer av hydros
 Hydros är mycket närvarande i en av de många typerna av batterier: som NIMH. Källa: Multicherry, CC BY-SA 4.0, via Wikimedia Commons
Hydros är mycket närvarande i en av de många typerna av batterier: som NIMH. Källa: Multicherry, CC BY-SA 4.0, via Wikimedia Commons Hydros finns i nickelmetalliska hydridbatterier (NIMH), som används gemensamt med sällsynta jordmetaller, kobolt eller mangan. Flera metallhydrorer har undersökts för användning i elbilar som drivs av vätrelaterade celler.
Kan tjäna dig: redoxbalansmetod: steg, exempel, övningarReducerande agenter
Litiumhydrid och natriumbor (NABH4) De används som kemiska reaktioner i organiska syntesreaktioner.
Vätelagring och andra relaterade användningsområden
Det finns piloter av väteanvändning som bränsle i motorfordon, men på grund av dess explosivitet har dess användning varit begränsad som bränsle. Användningen av hydros har föreslagits som en form av vätelagring för att därmed kontrollera deras fara.
Dessutom har hydrorer använts för rening och separering av väte- och temperatursensorer.
Torkmedel
Kalciumhydrid används för att ta bort vattnet som finns i organiska lösningsmedel.
Syror har sitt ursprung i molekylära hydrorer
Till exempel: saltsyra bildas av lösningen i ett vattenhaltigt medium av klorhydrid (HCl), med användning av saltsyra i eliminering av oxider som täcker järn, försurning av oljebrunnar, produktionen av klorid av kalcium och mineralbehandling.
Gödningsmedel
Ammoniaken (NH3) Det är en hydrid som används som en flytande gödningsmedel och tjänar för syntes av föreningar med ammoniumnitrat och ammoniumsulfat, som används som gödselmedel.
Vatten
Är den viktigaste hydriden. Det används i många branscher med olika användningsområden och applikationer. Vatten är det huvudsakliga ansvaret för att det finns levande varelser.
Exempel på hydrorer
Slutligen kommer andra exempel på hydror att listas med sina respektive formler och namn:
SNH4: tennhydrid | PH3: fosforhydrid (fosfin) eller fosfor trihydrid |
KH: blyhydrid | MGH2: Magnesiumhydrid eller magnesiumdihydruro |
KH: Kaliumhydrid | CH4: Carruro Carruro eller koltetrahydrid (metan) |
CAH2: Kalciumhydrid | FEH2: Järnhydrid (II) |
NAH: natriumhydrid | ZNH2: Zinkhydrid |
Lih: litiumhydrid | BAH2: Bariumhydrid |
CSH: cesiumhydrid | BH3: Boron Hydro (BAS |
Beh2: Beryl eller beryl dihydridhydrid | SIH4: Silicon Hydro (Silan) |
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan.). Cengage Learning.
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Wojes, ryan. (27 augusti 2020). Vad är en metallhydrid? Återhämtat sig från: tankco.com
- Amerikanska element. (2020). Hydridider. Hämtad från: Americanements.com
- Wikipedia. (2020). Hydrid. Hämtad från: i.Wikipedia.org
- Tandis arani. (15 augusti 2020). Hydridider. Kemi librettexts. Återhämtad från: kem.Librettexts.org
- Redaktörerna för Enyclopaedia Britannica. (2020). Hydrid. Återhämtat sig från: Britannica.com