Aluminiumhydroxidstruktur, egenskaper, användningar, risker
- 3469
- 105
- Johan Eriksson
han aluminiumhydroxid Det är en oorganisk förening vars kemiska formel är vid (OH)3. Till skillnad från andra metallhydroxider är det en amphotero, som kan reagera eller bete sig som en syra eller en bas, beroende på mediet. Det är ett ganska olösligt vitt fast ämne i vatten, så det finner användning som en komponent av antacida.
Som MG (OH)2 eller brucita, med vilken den delar vissa kemiska och fysiska egenskaper, ser rent ut som en amorf och glans fast; Men när de kristalliseras med vissa föroreningar förvärvar kristallina former som om de var pärlor. Bland dessa mineraler, naturliga källor till Al (OH)3, är Gibbsita.
 Special Gibbsita Crystal. Källa: Rob Lavinsky, irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]
Special Gibbsita Crystal. Källa: Rob Lavinsky, irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] Förutom Gibbsite finns också Bayerite, Nordstrandite och Doleyíta mineraler, som bildar de fyra aluminiumhydroxidpolymorferna. Strukturellt sett är de mycket lik varandra, differentierar varandra i vägen i hur skikten eller jonarken är belägna eller kopplade, liksom typen av föroreningar som finns.
Kontroll av pH- och syntesparametrarna kan någon av dessa polymorfer framställas. På samma sätt kan vissa kemiska arter av intresse isär mellan deras lager, så att material eller föreningar av ispedd skapas. Detta representerar användningen av mer teknisk strategi för Al (OH)3. Dess andra användningsområden är som antacida.
Å andra sidan används det som råmaterial för att erhålla aluminiumoxid, och dess nanopartiklar har använts som katalytiskt stöd.
[TOC]
Strukturera
Formel och octaedro
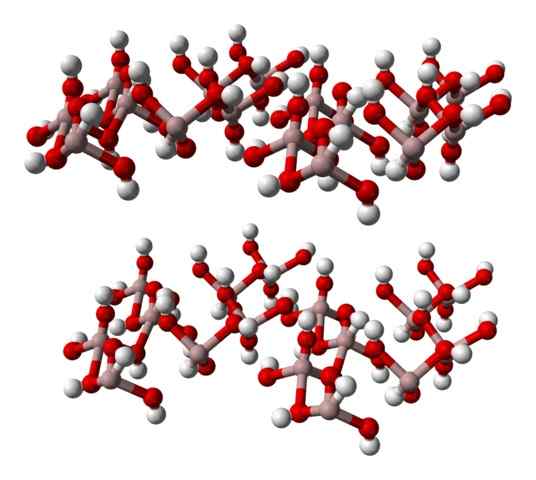
Den kemiska formeln vid (OH)3 indikerar en gång förhållandet till3+: Åh- Det är 1: 3; det vill säga det finns tre anjoner oh- för varje katjon till3+, vilket är detsamma som att säga att den tredje delen av dess joner motsvarar aluminium. Så al3+ och åh- De interagerar elektrostatiskt tills deras attraktioner-repulsioner definierar en hexagonal kristall.
Men al3+ Det är inte nödvändigtvis omgivet av tre OH- men sex; Därför talas det om en koordination Octahedron, vid (OH)6, där det finns sex interaktioner al-o. Varje oktaedron representerar en enhet som glaset är byggt med, och ett antal av dem antar trikliniska eller monokliniska strukturer.
Den nedre bilden representerar delvis oktaedra till (OH)6, Eftersom endast fyra interaktioner observeras för3+ (ljusbruna sfärer).
 Gibbsite hexagonal glas, ett aluminiumhydroxidmineral. Källa: Benjah-Bmm27 [Public Domain].
Gibbsite hexagonal glas, ett aluminiumhydroxidmineral. Källa: Benjah-Bmm27 [Public Domain]. Om denna struktur noggrant observeras, vilket motsvarar den för Gibbsite -mineralet, kan det övervägas att de vita sfärerna integrerar "ansikten" eller ytorna på jonlagren; Dessa är väteatomerna av OH -joner-.
Kan tjäna dig: hyra halogenuros: fastigheter, erhålla, exempelObservera att det finns ett lager A och en annan B (rumsligt är inte identiska), tillsammans med varandra av vätebroar.
Polymorfer
Skikt A och B är inte alltid kopplade på samma sätt, såväl som deras fysiska miljöer eller gästjoner (salter) kan förändras. Följaktligen är kristallerna från AL (OH)3 De varierar i fyra mineralogiska former eller i detta fall polymorfa.
Det sägs då att aluminiumhydroxid har upp till fyra polymorfer: Gibbsite eller Hydragilite (monoklinisk), Bayerite (monoklinisk), Doyleíta (tricycling) och Nordstrandite (Trichlinic). Av dessa polymorfer är Gibbsita den mest stabila och rikliga; De andra klassificeras som sällsynta mineraler.
Om kristallerna observerades vid mikroskopet, skulle man se att deras geometri är hexagonal (även om det är något oregelbundet). PH spelar en viktig roll i tillväxten av sådana kristaller och den resulterande strukturen; det vill säga med tanke på ett pH -pH ett polymorf eller annat.
Till exempel, om mediet där Al (OH) fälls ut3 Den har ett pH mindre än 5,8 Gibbsita bildas; Även om pH är större än detta värde, bildas Bayerita.
I mer grundläggande medier tenderar Nordstrandita och Doyleíta -kristaller att bilda. Således är det ett faktum som återspeglar surheten i dess vädervädermiljöer, som den vanligaste Gibbsite är ett faktum som återspeglar surheten i sina väderutveckling.
Egenskaper
Fysiskt utseende
Vitt fast ämne som kan komma i olika format: granulerat eller pulver och amorft utseende.
Molmassa
78.00 g/mol
Densitet
2,42 g/ml
Smältpunkt
300 ° C. Det har ingen kokpunkt eftersom hydroxid förlorar vatten för att förvandlas till aluminiumoxid eller aluminiumoxid, till2ANTINGEN3.
Vattenlöslighet
1 · 10-4 G/100 ml. Men lösligheten ökar med tillsats av syror (h3ANTINGEN+) eller alkalis (OH-).
Löslighetsprodukt
Ksp = 3 · 10−34
Detta lilla värde innebär att bara en liten del upplöses i vatten:
Al (OH)3(salt3+(AC) +3OH-(Ac)
Och i själva verket gör denna föraktliga löslighet det till en bra neutralisator av surhet, eftersom den inte baserar den gastriska miljön för mycket för att inte släppa nästan joner oh-.
Anoterism
AL (OH)3 Det kännetecknas av dess amphoter -karaktär; det vill säga det kan reagera eller bete sig som om det var en syra eller en bas.
Reagera till exempel med hjoner3ANTINGEN+ (Om mediet är vattenhaltigt) för att bilda den komplexa ACUO [till (åh2)6]3+; som i sin tur är hydrolyserad för att surgöra miljön, därför Al3+ en syrjon:
Kan tjäna dig: Cannizzaro -reaktion: egenskaper, mekanismer, exempelAl (OH)3(S) +3H3ANTINGEN+(AC) => [AL (OH2)6]3+(Ac)
[AL (OH2)6]3+(Ac) +h2Eller (l) [Al (OH2)5(Åh)]2+(Ac)+h3ANTINGEN+(Ac)
När detta händer sägs det att Al (OH)3 Det beter sig som en bas, eftersom den reagerar med h3ANTINGEN+. Å andra sidan kan du reagera med OH-, bete sig som en syra:
Al (OH)3(S) +oh-(ac) => ah (oh)4-(Ac)
I denna reaktion den vita fällningen av Al (OH)3 Det löses upp till överskottet av joner oh-; faktum som inte händer samma sak med andra hydroxider, såsom magnesium, MG (OH)2.
AL (OH)4-, ALUMINATE JON, det kan uttryckas mer lämpligt som: [Al (OH2)2(ÅH)4]-, Markera samordningsantalet 6 för katjon till3+ (Octaedro).
Denna jon kan fortsätta reagera med mer OH- Fram till koordinationen Octahedron: [AL (OH)6]3-, kallas hexahidroxoaluminatjon.
Nomenklatur
Namnet 'Aluminiumhydroxid', som mest hänvisar till denna förening, motsvarar de styrda av lager nomenklaturen. (Iii) utelämnas i slutet av den, eftersom aluminiumoxidationsstatusen är +3 i alla dess föreningar.
De andra två möjliga namnen för att hänvisa till Al (OH)3 De är: aluminium trihydroxid, enligt den systematiska nomenklaturen och användningen av grekiska numeratorer; och aluminiumhydroxid, slutar med suffixet -ico för att ha ett enda oxidationstillstånd.
Även i det kemiska fältet nomenklaturen för Al (OH)3 Det representerar ingen utmaning eller förvirring, utanför det tenderar att blandas med oklarheter.
Till exempel är Gibbsita Mineral en av de naturliga polymorferna för AL (OH)3, som de också namnger som γ-Al (OH)3 eller α-Al (OH)3. Men a-Al (OH)3 Det kan också motsvara Bayerita Mineral, eller ß-Al (OH)3, Enligt den kristallografiska nomenklaturen. Samtidigt betecknas vanligtvis Nordstrandita och Doyleita -polymorfer helt enkelt som (OH)3.
Följande lista sammanfattar tydligt den nyligen förklarade:
-Gibbsita: (y eller α) -al (OH)3
-Bayerita: (α eller ß) -al (OH)3
-Nordstrandita: Al (OH)3
-Doyleita: Al (OH)3
Ansökningar
Råmaterial
Den omedelbara användningen av aluminiumhydroxid är lika råmaterial för produktion av aluminiumoxid eller andra föreningar, oorganiska eller organiska, aluminium; Till exempel: Alcl3, Med inte3)3, Alf3 eller Naal (OH)4.
Katalytisk stöd
AL (OH) nanopartiklar3 De kan fungera som katalytiska stöd; det vill säga katalysatorn förenar dem som ska fixeras på ytan, där kemiska reaktioner accelereras.
Kan tjäna dig: Syntesreaktion: Typer, faktorer, exempelInternationella föreningar
I strukturavsnittet förklarades att Al (OH)3 Den består av lager eller ark A och B, kopplad för att definiera en kristall. Inom det finns det små oktaedriska utrymmen eller hål som kan ockuperas av andra joner, metalliska eller organiska eller neutrala molekyler.
När kristaller syntetiseras från (OH)3 Med dessa strukturella modifieringar sägs det att en förening av interkalation bereds; det vill säga isär eller lägga kemiska arter mellan ark A och B. På så sätt uppstår nya material som tillverkas av denna hydroxid.
Brandskyddsmedel
AL (OH)3 Det är en bra brandhämmande medel som finner applicering som fyllningsmaterial av många polymermatriser. Detta beror på att det absorberar värme för att frigöra vattenånga, som MG (OH) gör2 eller brucita.
Medicinsk
AL (OH)3 Det är också en neutraliserande surhet och reagerar med HCL för gastriska sekret; Återigen, liknande hur det händer med MG (OH)2 av magnesia mjölk.
Båda hydroxiderna kan blandas i olika antacida, som används för att lindra symtomen på människor som lider av gastrit eller magsår.
Adsorbent
När den värms under sin smältpunkt förvandlas aluminiumhydroxid till aktiverad aluminiumoxid (liksom aktivt kol). Detta fasta ämne används som adsorbent av oönskade molekyler, antingen färgämnen, föroreningar eller förorenande gaser.
Risker
Riskerna som kan representera aluminiumhydroxid beror inte på den som solid, utan som ett läkemedel. Inget protokoll eller förordningar behövs för att lagra det, eftersom det inte reagerar kraftigt med oxiderande medel, och det är inte heller brandfarligt.
När de intas i antacida som uppnås på apotek kan oönskade biverkningar förekomma, såsom förstoppning och hämning av tarmfosfat. Även, och även om det inte finns några studier som visar det, har det varit förknippat med neurologiska störningar som Alzheimers sjukdom.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Wikipedia. (2019). Hydroxidaluminium. Hämtad från: i.Wikipedia.org
- Nationellt centrum för bioteknikinformation. (2019). Hydroxidaluminium. Pubchemdatabas. CID = 10176082. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Danielle Reid. (2019). Hydroxidaluminium: Formel och biverkningar. Studie. Återhämtat sig från: studie.com
- Robert Schoen & Charles och. Roberson. (1970). Strukturer av aluminiumhydroxid och geokemiska implikationer. The American Mineralogist, Vol 55.
- Vitaly p. Isupov & col. (2000). Syntes, struktur, egenskaper och applicering av aluminiumhydroxidintercalationsföreningar. Kemi för hållbar utveckling 8 121-127.
- Läkemedel. (24 mars 2019). Aluminiumhydroxidbiverkningar. Återhämtat sig från: droger.com
- « Vanadio historia, egenskaper, struktur, användningar
- Nickelhistoria, egenskaper, struktur, användningsområden, risker »

