Ammoniumhydroxid
- 3262
- 991
- Anders Larsson
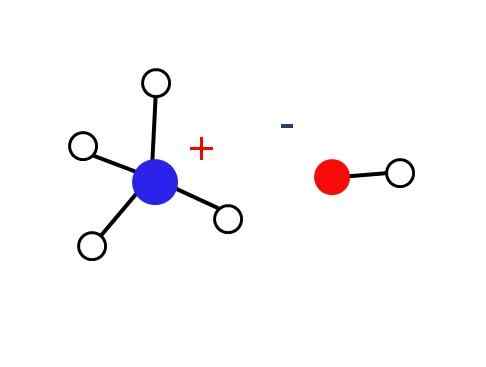
 Elektrostatisk interaktion mellan ammonium- och vattenjoner. Källa: Gabriel Bolívar
Elektrostatisk interaktion mellan ammonium- och vattenjoner. Källa: Gabriel Bolívar Vad är ammoniumhydroxid?
han Ammoniumhydroxid Det är en NH -molekylformelförening4Åh åh5Inte det produceras av lösningen av ammoniakgas (NH3) I vatten. Av den anledningen får den vätskedamnen ammoniak eller ammoniakvatten.
Det är en färglös vätska och en mycket intensiv och skarp, inte isolerbar lukt. Dessa egenskaper har en direkt relation med NH -koncentrationen3 Löst i vatten, koncentration som kan täcka enorma mängder ammoniak upplöst i liten volym vatten, eftersom det är en gas.
En betydligt liten del av dessa vattenhaltiga lösningar består av NH -katjoner4+ Och oh anjoner-.
Å andra sidan, i mycket utspädda lösningar eller i frysta fasta ämnen vid mycket låga temperaturer, kan ammoniak hittas i form av hydrater, till exempel: NH3∙ h2Eller, 2nh3∙ h2Eller och nh3∙ 2h2ANTINGEN.
Kemisk struktur av ammoniumhydroxid
Ammoniumhydroxid består av en vattenhaltig ammoniakgaslösning. Därför finns det ingen definierad struktur inom vätskan som inte är en slumpmässig bortskaffande av NH -joner4+ och åh- Solvated av vattenmolekyler.
Ammonium- och hydroxyljoner är produkten av en ammoniakhydrolysbalans, så det är vanligt att dessa lösningar har en genomträngande lukt:
Nh3(g) + h2Eller (l) nh4+(AC) + OH-(Ac)
Enligt den kemiska ekvationen skulle en hög minskning av vattenkoncentrationen förflytta balansen till den mest ammoniakformationen, det vill säga när ammoniumhydroxid värms upp, ammoniakångor kommer att frigöras.
Av denna anledning, NH -joner4+ och åh- De inte bildar en kristall under markförhållanden, vilket resulterar i den fasta NH -basen4Åh finns inte.
Nämnda fastigheter bör endast komponeras av joner som interagerar elektrostátiskt (som framgår av bilden).
Fysiska och kemiska egenskaper
Molekylär formel
Nh4Åh åh5NEJ
Molekylvikt
35,046 g/mol
Aspekt
Färglös vätska.
Koncentration
Upp till cirka 30% (för NH -joner4+ och åh-).
Lukt
Mycket stark och skarp.
Smak
Tunnland.
Tröskelvärde
34 ppm för ospecifik upptäckt.
Kokpunkt
38 ºC (25%).
Löslighet
Det finns bara i vattenlösning.
Vattenlöslighet
Belopp i obegränsade proportioner.
Densitet
0,90 g/cm3 vid 25 ºC.
Ångtäthet
Relativt luften som tagits som enheten: 0,6. Det vill säga det är mindre tätt än luften. Logiskt hänvisar emellertid det rapporterade värdet till ammoniak som gas, inte dess vattenhaltiga lösningar eller NH4Åh.
Kan tjäna dig: Dipolar Moment: Hur det beräknas och exempelÅngtryck
2.160 mmHg vid 25 ºC.
Frätande handling
Det kan lösa upp zink och koppar.
pH
11.6 (lösning 1 n); 11.1 (lösning 0,1 n) och 10.6 (lösning 0,01 n).
Dissociationskonstant
PKB = 4 767; KB = 1,71 x 10-5 vid 20 ºC
PKB = 4 751; Kb = 1 774 x 10-5 vid 25 º C
Ökningen i temperaturen ökar nästan omöjligt basen för ammoniumhydroxid.
Nomenklatur
Nh4OH får vanliga och officiella namn, i enlighet med bestämmelserna i IUPAC. Hans namn är ammoniumhydroxid för att innehålla hydroxylanjon.
Ammonium för dess +1 -belastning är monovalent, så att använda beståndsnomenklaturen kallas ammoniumhydroxid (I).
Men användningen av "ammoniumhydroxid" är tekniskt felaktig, eftersom föreningen inte är isolerbar (åtminstone inte på jorden, som förklaras i det första avsnittet).
Det får också flytande ammoniak- och ammoniakvattennamn.
Löslighet
Som NH4Åh finns inte som salt under markförhållanden, det kan inte uppskattas hur lösligt det är i olika lösningsmedel.
Man kan dock förvänta sig att det skulle vara extremt lösligt i vatten, eftersom dess upplösning skulle släppa enorma mängder NH3.
Teoretiskt sett skulle det vara ett fantastiskt sätt att lagra och transportera ammoniak.
I andra lösningsmedel som kan acceptera vätebroar, såsom alkoholer och aminer, kan det förväntas att det också skulle vara mycket lösligt i dem. Här katjon NH4+ Det är en givare av vätebroar, och OH- Begränsning som båda.
Exempel på dessa interaktioner med metanol skulle vara: h3N+-H - ohch3 och ho- - Hoch3 (Ohch3 Indikerar att syre får vätebron, inte att metylgruppen är kopplad till H).
Risker
- I kontakt med ögonen orsakar det irritation som kan leda till okulära skador.
- Det är frätande. Därför kan den i kontakt med huden ge irritation, och vid höga koncentrationer av reagenset orsakar hudförbränningar. Upprepad kontakt med ammoniumhydroxid med huden kan orsaka dess torrhet, klåda och rodnad (dermatit).
- Inandning av en dagg av ammoniumhydroxid, kan orsaka akut irritation i luftvägarna, kännetecknad av kvävning, hosta eller luftbrist.
- Den långvariga eller upprepade exponeringen av ämnet kan resultera i återkommande infektioner i bronkierna. På samma sätt kan ammoniumhydroxidinandning orsaka lungirritation.
Kan tjäna dig: Strontium hydroxid (SR (OH) ₂)- Exponering för höga koncentrationer av ammoniumhydroxid kan utgöra en medicinsk nödsituation, eftersom en vätskeansamling kan uppstå i lungorna (lungödem).
- 25 ppm koncentration har tagits som en exponeringsgräns, i en 8 -timmars arbetsskift, i en miljö där arbetaren utsätts för den skadliga verkan av ammoniumhydroxid.
Reaktivitet
Förutom de potentiella hälsoskadorna på grund av exponering för ammoniumhydroxid finns det annan försiktighet som måste beaktas när man arbetar med ämnet.
- Ammoniumhydroxid kan reagera med många metaller, till exempel: silver, koppar, bly och zink. Det reagerar också med salterna från dessa metaller för att bilda explosiva föreningar och frigöra vätgas, vilket i sin tur är brandfarligt och explosivt.
- Det kan reagera våldsamt med starka syror, till exempel: saltsyra, svavelsyra och salpetersyra. Det reagerar också på samma sätt med dimetylsulfat och halogener.
- Reagerar med starka baser, såsom natriumhydroxid och kaliumhydroxid, vilket producerar gasformad ammoniak. Detta kan verifieras om balansen i lösningen observeras, där tillsatsen av OH -joner- förskjuter balansen till bildandet av NH3.
- Koppar- och aluminiummetaller bör inte användas, såväl som andra galvaniserade metaller, när ammoniumhydroxid manipuleras på grund av dess frätande verkan på dem.
Ansökningar
I mat
- Det används som ett tillsatsmedel i många livsmedel där det uppfyller funktionerna hos ett sprutmedel, kontroll av pH och medel för livsmedelsfinishen.
- Listan över livsmedel där ammoniumhydroxid används är omfattande och inkluderar bakade produkter, ostar, choklad, godis och pudiner.
- Ammoniumhydroxid katalogiseras som ett oskyldigt ämne av FDA för livsmedelsbearbetning, förutsatt att de etablerade normerna följs.
- I köttprodukter används det som ett antimikrobiellt medel och kan eliminera bakterier som OCH. coli, reducera den till odetekterbara nivåer. Bakterien finns i tarmen hos nötkreatur och anpassar sig till den sura miljön. Ammoniumhydroxid, när man reglerar pH, hindrar bakterietillväxt.
Terapeutik
Ammoniumhydroxid har flera terapeutiska användningar, bland dem:
- 10% -lösningen används som en andningsreflexstimulant.
Det kan tjäna dig: alfa-zotoglutarat: egenskaper, funktioner och applikationer- Externt används det på huden för behandling av insekts- och bitbitar.
- Det verkar i matsmältningssystemet som antacida och karminativt, det vill säga det hjälper till att eliminera gaser.
- Det används som ett aktuellt gummi. Som en följd av denna åtgärd finns det en lokal ökning av blodflödet, rodnad och irritation.
Industriell och diverse
- Handlingar i reduktionen av NOx (mycket reaktiva gaser såsom kväveoxid (NO) och kvävedioxid (NO2)) För batteriutsläpp och NOx -minskning av skorstenutsläpp.
- Det används som ett mjukgöringsmedel, tillsatsmedel av målningar och för behandling av ytor.
- Hårets porositet ökar så att färgpigment kan ha större penetration, vilket uppnår en bättre finish.
- Ammoniumhydroxid används som ett antimikrobiellt medel vid behandling av avloppsvatten. Dessutom ingriper det i syntesen av kloramin. Detta ämne uppfyller en klorfunktion i rening av poolvattnet, med fördelen att vara mindre giftig.
- Det används som en korrosionsinhibitor i oljeraffineringsprocessen.
- Det används som rengöringsmedel i olika industriella och kommersiella produkter, som används på flera ytor, inklusive rostfritt stål, porslin, glas och ugnar.
- Det används vid produktion av tvättmedel, tvålar, läkemedelsprodukter och bläck.
I jordbruket
- Även om det inte direkt administreras som gödningsmedel, uppfyller ammoniumhydroxid denna funktion. Ammoniaken inträffar från det atmosfäriska kvävet med metoden att ha-Bosch och transporteras kyld under dess kokpunkt (-33 ºC) till platserna för dess användning.
- Den trycksatta ammoniaken injiceras, i form av ånga, inuti jorden, där den reagerar omedelbart med edafiskt vatten och passerar till form av ammonium (NH4+), som bibehålls på jordens utbytesställen. Dessutom inträffar ammoniumhydroxid. Dessa föreningar är en källa till kväve.
- Tillsammans med fosfor och kalium utgör kväve den viktigaste näringstriaden för de väsentliga växterna för deras tillväxt.
Referenser
- Helmestine, Anne Marie, PH.D. Ammoniumhydroxidfakta. Återhämtat sig från Thoughtco.com
- Informationsblad om farliga ämnen: ammoniumhydroxid [PDF]. Återhämtat sig från NJ.Gov
- Ammoniumhydroxid. Återhämtat sig från kemi.com

