Meniscus (kemi)
- 679
- 5
- Per Eriksson
 Konkav och konvex menisk. Källa: Wikimedia Commons
Konkav och konvex menisk. Källa: Wikimedia Commons Vad är menisken (kemi)?
han menisk Det är krökningen på ytan på en vätska. Det är också den fria ytan på en vätska i vätskelugränssnittet. Vätskor kännetecknas av att ha en fast volym, att vara avkommande.
Vätskans form varierar dock att anta formen på behållaren som innehåller dem. Denna egenskap beror på den slumpmässiga rörelsen av molekylerna som bildar dem.
Vätskor har förmågan att flyta, hög densitet och spridas snabbt i andra vätskor som de är blandbara.
De upptar behållarens lägsta område och lämnar en fri inte helt plan yta på toppen. Under vissa omständigheter kan de anta speciella former som droppar, bubblor och bubblor.
Egenskaperna hos vätskor såsom smältpunkten, ångtrycket, viskositeten och förångningsvärmen beror på intensiteten hos de intermolekylära krafterna som ger sammanhållning till vätskor.
Vätskor interagerar dock också med behållaren genom vidhäftningskrafter.
Menisken uppstår sedan från dessa fysiska fenomen: skillnaden mellan sammanhållningskrafter mellan flytande partiklar och vidhäftning, vilket gör att de kan våta väggarna.
Vad är menisken?
Som förklarats är menisken resultatet av flera fysiska fenomen, bland vilka vätskans ytspänning också kan nämnas.
Sammanhållningskrafter
Sammanhållningskrafter är den fysiska termen som förklarar intermolekylära interaktioner i vätskan. När det gäller vatten beror sammanhållningskrafter på dipol-dipolo-interaktion och vätebroar.
Kan tjäna dig: kloroxid (iii): egenskaper, struktur, användningarVattenmolekylen är bipolär natur. Detta beror på att molekylens syre är elektronegativt eftersom det har större aviditet på grund av elektroner än hydrogener, vilket bestämmer att syre förblir med en negativ belastning och hydrogener är positivt laddade.
Det finns en elektrostatisk attraktion mellan den negativa belastningen av en vattenmolekyl, belägen i syre, och den positiva belastningen på en annan vattenmolekyl, belägen i hydrogener.
Denna interaktion är vad han vet som en dipol-dipolinteraktion eller kraft, som bidrar till vätskesammanhållning.
Vidhäftningskrafter
Å andra sidan kan vattenmolekyler interagera med glasväggar, genom partiell belastning av väteatomerna i vattenmolekylerna som binder syreatomerna i ytan på glaset i glaset i syreatomerna.
Detta utgör vidhäftningskraften mellan vätskan och den styva väggen, vilket i allmänhet innebär att vätskan väter väggen.
När en silikonlösning placeras på glasytan impregnerar vattnet inte helt glaset utan bildas på detta några droppar som lätt elimineras.
Således indikeras det att vid denna behandling reduceras vidhäftningskraften mellan vatten och glas.
Ett mycket liknande fall inträffar när händerna är fet, och när man tvättar dem med vatten kan mycket definierade droppar ses på huden istället för den fuktade huden.
Typer av menisker
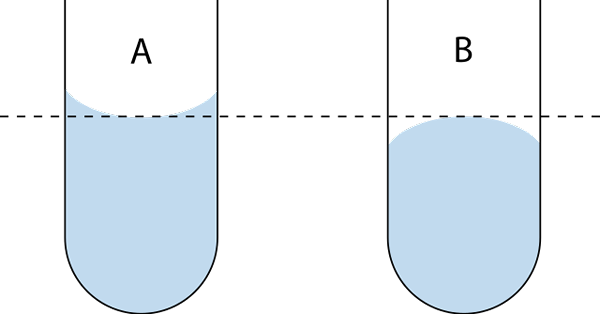
Det finns två typer av menisk: det konkava och det konvexa. I den överlägsna bilden är den konkava A och den konvexa B. De streckade linjerna indikerar rätt spolning när du läser ett volymmått.
Kan tjäna dig: neutral atomKonkav menisk
 Konkava meniskåtgärder. Källa: Wikimedia Commons
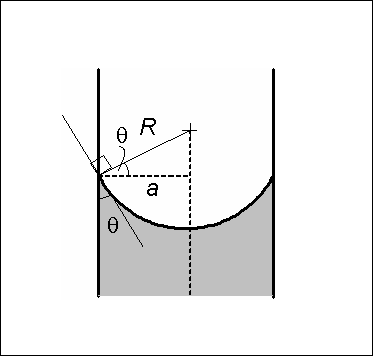
Konkava meniskåtgärder. Källa: Wikimedia Commons Den konkava menisken kännetecknas av att kontaktvinkeln θ som bildar glasets vägg med en tangentlinje till menisken, som införs i vätskans barm, har ett värde mindre än 90º.
Om en flytande mängd placeras på glaset tenderar det att spridas på glasytan.
Närvaron av en konkav menisk.
Därför bad vätskan eller våtar glasväggen, behåller en mängd vätska och ger menisken konkav. Vatten är ett exempel på en vätska som bildar konkav menisk.
Konvex menisk
När det gäller den konvexa menisken har kontaktvinkeln θ ett värde större än 90º. Kvicksilver är ett exempel på en vätska som bildar konvex menisk. När en droppe kvicksilver placeras på en glasyta har kontaktvinkeln θ ett värde på 140º.
Observation av en konvex menisk. Det sägs att vätskan inte våtar glaset.
De ytliga krafterna för sammanhållning (vätskevätska) och vidhäftning (vätskefelfast) är ansvariga för många fenomen av biologiskt intresse, såsom fallet med ytspänning och kapillaritet.
Ytspänning
Ytspänning är en nettoattraktionskraft som utövas på de flytande molekylerna som finns på ytan och som tenderar att introducera dem i vätskan.
Kan tjäna dig: diatomiska elementDärför tenderar ytspänningen att kohosla vätskan och ge mer konkav menisk. Med andra ord tenderar denna kraft att ta bort ytan på glasväggsvätskan.
Ytspänningen tenderar att minska när temperaturen ökar, till exempel: ytvattenspänningen är lika med 0,076 N/m A 0 ° C och 0,059 N/m A 100 ° C.
Medan ytspänningen på kvicksilveret vid 20 ° C är 0,465 N/m. Detta skulle förklara varför kvicksilverformer konvexa menisk.
Kapillaritet
Om kontaktvinkeln θ är mindre än 90º, och vätskan väter glasväggen, kan vätskan inuti glaskapillärerna stiga upp tills de når ett balansförhållanden.
Viktkolonnens vikt kompenseras av den vertikala komponenten i sammanhållningskraften på grund av ytspänning. Vidhäftningskraften ingriper inte eftersom den är vinkelrätt mot rörytan.
Denna lag förklarar inte hur vatten kan stiga upp från rötter till bladen genom xylemkärlen.
Egentligen finns det andra faktorer involverade i detta avseende, till exempel: när vatten avdunstar i bladen, tillåter det vattenmolekylerna att sugas i den övre delen av kapillärerna.
Detta gör att andra molekyler längst ner i kapillärerna kan stiga upp för att ockupera platsen för de förångade vattenmolekylerna.
Referenser
- Whitten, Davis, Peck & Stanley. Kemi. Cengage Learning.
- Helmestine, Anne Marie, PH.D. Hur man läser menisk i kemi. Återhämtat sig från Thoughtco.com

