Magnesiumhydroxidstruktur, egenskaper, nomenklatur, användningar

- 3714
- 150
- Erik Eriksson
han magnesiumhydroxid Det är en oorganisk förening vars kemiska formel är mg (OH)2. I sin rena form är det ett vitt fast ämne utan ljusstyrka och amorft utseende; Men med ett litet och exakt innehåll av föroreningar förvandlas det till den kristallina fasta brucita, ett mineral som är i vissa avlagringar i naturen och är en rik källa till magnesium.
Det är en svag elektrolyt eller bas, så dess dissociation är låg i vatten. Den här egenskapen gör MG (OH)2 en bra surhetsneutralisator för konsumtion; Populärt känt botemedel som avstängning av mjölk från magnesia. Det är också en brandhämmande genom att släppa vatten under dess termiska nedbrytning.
 Fast magnesiumhydroxidprov. Källa: Chemicalinterest [Public Domain]
Fast magnesiumhydroxidprov. Källa: Chemicalinterest [Public Domain] I den övre bilden visas några fasta ämnen med magnesiumhydroxid, där dess ogenomskinliga vita färg kan ses. Ju mer kristallina de är, de utvecklar glasartade och pärlytor.
Dess kristallina struktur är speciell eftersom den upprättar dubbelskiktshexagonala kristaller, som är lovande mönster för design av nya material. I dessa lager spelar deras positiva belastningar en viktig roll på grund av ersättningen av MG2+ av trivalenta katjoner, och till arten som är begränsade mellan väggarna som består av OH -anjoner-.
Å andra sidan härstammar andra tillämpningar beroende på morfologin hos beredda partiklar eller nanopartiklar; som katalysatorer eller adsorbenter. I alla av dem är förhållandet 1: 2 för Mg -joner konstant2+: Åh-, återspeglas i samma Mg -formel (OH)2.
[TOC]
Strukturera
Formel och octaedro
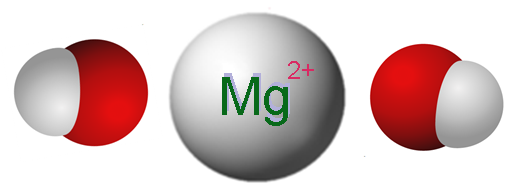 Joner som utgör magnesiumhydroxid. Källa: Claudio Pistilli [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]
Joner som utgör magnesiumhydroxid. Källa: Claudio Pistilli [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] Den överlägsna bilden visar jonerna som utgör MG (OH)2. Som man kan se finns det två anjoner oh- För varje katjon mg2+, som interagerar elektrostatiskt för att definiera en hexagonal strukturkristall. Samma formel indikerar att Mg -förhållandet: OH är 1: 2.
Den verkliga kristallina strukturen är emellertid lite mer komplicerad än att anta enkla Mg -joner2+ och åh-. Egentligen kännetecknas magnesium av att ha ett samordningsantal på 6, så det kan interagera med upp till sex OH-.
Således bildas octahedron mg (OH)6, Där syreatomer uppenbarligen kommer från OH-; Och den kristallina strukturen vilar nu på övervägandet av sådan oktaedra och hur de interagerar med varandra.
Faktum är att Mg (OH) -enheter6 De slutar definiera dubbla skiktstrukturer som i sin tur beordras i rymden för att orsaka hexagonal glas.
Kan tjäna dig: atomviktDubbelt lager
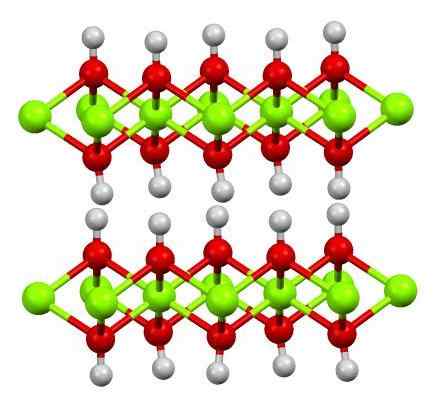 Dubbelskikt av magnesiumhydroxid. Källa: Smokefoot [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]
Dubbelskikt av magnesiumhydroxid. Källa: Smokefoot [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] Den övre bilden visar det dubbla lagret av magnesiumhydroxid (LDH) Skiktade dubbla hydroxider). Gröna sfärer representerar Mg -joner2+, som kan ersättas av andra med större belastning för att generera en positiv belastning i lagret.
Observera att runt varje mg2+ Det finns sex röda sfärer kopplade till deras respektive vita sfärer; det vill säga de oktaedriska enheterna mg (OH)6. ÅH- Det fungerar som en bro för att gå med två mg2+ av olika plan, vilket gör att skikten är begränsade.
På samma sätt observeras att väteatomer pekar upp och ner och är de första ansvariga för intermolekylära krafter som håller de två lagren av Mg (OH) -enheter tillsammans6.
Bland dessa lager, neutrala molekyler (som alkoholer, ammoniak och kväve) eller till och med anjoner, beroende på hur positiva de är (om det finns joner är3+ eller tro3+ Ersätter MG2+). "Fyllningen" av dessa arter begränsas av ytorna som består av OH -anjoner-.
Morfologier
Det sexkantiga och dubbla skiktglaset växer långsamt eller snabbt. Det beror på syntes- eller beredningsparametrarna: temperatur, molförhållande, agitation, lösningsmedel, reagens som en källa till magnesium, baser eller utfällningsmedel etc. När glaset växer, definiera mikrostrukturen eller morfologin i dess nanopartiklar eller aggregat.
Således kan dessa nanopartiklar ha rätter, blodplättar eller blomkål. På samma sätt kan fördelningen av dess storlekar förändras, liksom graden av porositet hos de resulterande fasta ämnena.
Egenskaper
Fysiskt utseende
Det är en vit, granulerad eller pulveriserad fast och toalett.
Molmassa
58,3197 g/mol.
Densitet
3,47 g/ml.
Smältpunkt
350 ºC. Vid denna temperatur bryts den ned i oxiden genom att frigöra vattenmolekylerna i deras kristaller:
Mg (OH)2(s) => mgo (s) +h2O (g)
Vattenlöslighet
0,004 g/100 ml vid 100 ° C; Det vill säga, det lyckas knappt lösa upp i kokande vatten, så det är en olöslig förening i vatten. Genom att minska pH (eller öka surheten) ökas emellertid lösligheten genom bildningen av den komplexa ACUO, MG (OH2)6.
Å andra sidan, om MG (OH)2 har absorberat Co2, kommer att frigöra gasen som behålls som brus vid upplösning i ett surt medium.
Kan tjäna dig: helium: historia, egenskaper, struktur, risker, användningarBrytningsindex
1 559
pH
En vattenhaltig suspension av den har ett pH som varierar mellan 9,5 och 10,5. Även om dessa värden är normala återspeglar det dess lilla basicitet mot andra metallhydroxider (som NaOH).
Värmekapacitet
77.03 j/mol · k
Var ligger det?
 Blue Brucita Blue Blut. Källa: Rob Lavinsky, irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]
Blue Brucita Blue Blut. Källa: Rob Lavinsky, irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] Magnesiumhydroxid finns i naturen som brucita -mineralet, som kännetecknas av dess transparenta vita färg, med gröna eller blåaktiga toner beroende på dess föroreningar. Likaså är brucita en del av vissa leror, såsom klorit, när det är blandat mellan skikten av silikater, förenade med metalljoner.
I La Brucita finns det andra joner utöver MG2+, som Al3+, Tro3+, Zn2+ och mn2+. Deras menas finns i olika regioner eller sjöar i Skottland, Kanada, Italien och USA.
Fysiskt ser deras kristaller.
Detta mineral är ett av de ondska som påverkar cement och betong, eftersom det tenderar att expandera och orsaka frakturer i dem. Det absorberar emellertid inte CO2, Så dess kalcinering bidrar inte till växthuseffekten och därför är det en lämplig mineralogisk källa (och den rikaste) att få magnesium, utöver havsvatten.
Nomenklatur
MG (OH)2 Det har upp till tre namn som accepteras av IUPAC (ur mineralogi eller medicin). Dessa liknar varandra, eftersom precis som de slutar.
Till exempel motsvarar 'magnesiumhydroxid' dess namn enligt lager nomenklaturen, som utelämnar (ii) i slutändan eftersom +2 nästan som standard är det enda oxidationstillståndet av magnesium.
'Magnesium dihydroxid', pekar med den grekiska telleren prefixet antalet OH -joner- anges i formeln enligt den systematiska nomenklaturen. Och "magnetisk hydroxid", som slutar med suffixet -ico för att vara det maximala och "unika" tillståndet för oxidation av magnesium, enligt den traditionella nomenklaturen.
De andra namnen, såsom brucita eller magnesimjölk, även om de är direkt relaterade till denna förening, är det inte bekvämt att hänvisa till den när det gäller dess renaste fasta, eller som en oorganisk förening (reagens, råmaterial etc.).
Ansökningar
Neutraliserare
MG (OH)2 På grund av dess låga löslighet i vatten det faktum att det är en utmärkt surhetsneutralisator; Annars skulle mediet baseras när man bidrar med stora koncentrationer av OH -joner-, Som andra baser (starka elektrolyter) gör.
Kan tjäna dig: kemisk hybridiseringSåledes MG (OH)2 Släpp knappt OH-, Samtidigt reagerar det med hjoner3ANTINGEN+ För att bilda magnesiumkomplexet, också nämnt ovan. Att kunna neutralisera surhet hos vattenhaltiga medier är det avsett för behandling av avloppsvatten.
Det är också ett tillsats av mat, gödselmedel och vissa personliga hygienprodukter, såsom tandkräm, eftersom dess surhet minskar.
Antakida
Att vara lite vattenlöslig kan det tas utan att riskera effekterna av dess OH -joner- (Mycket lite dissocierar som svag elektrolyt).
Denna egenskap, kopplad till underavsnittet från ovan, gör det till en antacida att behandla magsyra, gastrointestinala sjukdomar, matsmältningsbesvär och förstoppning, som säljs under formeln av magnesimjölk.
Å andra sidan hjälper mjölk från magnesia också att bekämpa de irriterande ansikten (de vita och rödade såren som förekommer i munnen).
Brandskyddsmedel
I avsnittet Egenskaper nämndes att MG (OH)2 Det bryter ner och släpper vatten. Exakt hjälper sådant vatten att stoppa framstegen av lågorna, eftersom de absorberar värme för att förångas och i sin tur spädde ångorna brännbara eller brandfarliga gaser.
Brucita -mineralet används vanligtvis industriellt för detta ändamål, avsett som att fylla i vissa material, såsom plast av olika polymerer (PVC, hartser, gummi), kablar eller tak.
Katalysator
MG (OH)2 Syntetiserad som nanoplaquetas har visat sig vara effektiv för att katalysera kemiska reduktioner; Till exempel 4-nitrofenolen (pH-no2) En 4-aminofenol (PH-NH2). De har också antibakteriell aktivitet, så den kan användas som ett terapeutiskt medel.
Adsorbent
Några mg (OH) fasta ämnen2 De kan vara ganska porösa, beroende på metoden för deras förberedelser. Därför finner de tillämpning som adsorbenter.
I vattenhaltiga lösningar kan de adsorbera (på sina ytor) färgmolekylerna, klargöra vattnet. Till exempel kan de adsorbera Indigo Carmine Dye som finns i vattenströmmar.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Wikipedia. (2019). Hydroxidmagnesium. Hämtad från: i.Wikipedia.org
- Nationellt centrum för bioteknikinformation. (2019). Hydroxidmagnesium. Pubchemdatabas. CID = 14791. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Ametistgallerier. (2014). Mineralbruciten. Återhämtat sig från: gallerier.com
- Henrist et al. (2003). Morfologisk studie av magnesiumhydroxid -nanopartiklar
- utfällt i utspädd vattenlösning. Journal of Crystal Growth 249, 321-330.
- Saba j., Shanza R. K., Muhammad r. S. (2018). Syntes och strukturell analys av mesoporös magnesiumhydroxid -nanopartiklar som effektiv katalysator.
- Thimmasandra Narayan Ramesh och Vani Pavada Sreenivasa. (2015). Avlägsnande av indigo karminfärgning från vattenlösning med hjälp av magnesiumhydroxid som adsorbent. Journal of Materials, Vol. 2015, artikel ID 753057, 10 sidor. doi.org/10.1155/2015/753057
- « Nickelhistoria, egenskaper, struktur, användningsområden, risker
- Carlos Pellicer Chamber Biografi, stil, verk, fraser »

