Immunglobuliner
- 1363
- 126
- Johan Olsson
 Illustration av immunglobuliner
Illustration av immunglobuliner Vad är immunglobuliner?
De Immunglobuliner Det är molekyler som tillverkar B -lymfocyter och plasmaceller som samarbetar med organismen. De består av ett glykoproteinbiomolekyl som tillhör immunsystemet. De är ett av de vanligaste proteinerna i blodserumet efter albumin.
Antikropp är ett annat namn som immunglobuliner får och betraktas som globuliner på grund av deras beteende i elektrofores i blodserumet som innehåller dem. Immunoglobulinmolekylen kan vara enkel eller komplex, beroende på om din presentation är som en monomer eller är polymeriserad.
Den gemensamma strukturen för immunglobuliner liknar bokstaven "Y". Det finns fem typer av immunglobuliner som har morfologiska, funktionella och platsskillnader i kroppen. De strukturella skillnaderna i antikropparna är inte i form, utan när det gäller deras sammansättning; Varje typ har ett specifikt mål.
Immunsvaret som främjas av immunglobuliner är mycket specifik och är en mycket komplex mekanism. Stimulus för sin utsöndring av celler aktiveras i närvaro av konstiga medel till kroppen, till exempel en bakterie. Funktionen av immunglobulin är att gå med i det konstiga elementet och eliminera det.
Immunoglobuliner eller antikroppar kan vara närvarande både i blodet och på den membranösa ytan av organen. Dessa biomolekyler representerar viktiga element inom människokroppssystemet.
Immunglobuliner

Antikroppsstrukturen innehåller aminosyror och kolhydrater, oligosackarider. Den dominerande närvaron av aminosyror, dess kvantitet och distribution är det som bestämmer strukturen för immunglobulin.
Liksom alla protein har immunglobuliner primära, sekundära, tertiära och kvartära strukturer, vilket bestämmer deras typiska utseende.
Som svar på antalet aminosyror som de presenterar har immunglobuliner två typer av kedja: tung kedja och lätt kedja. Dessutom, enligt aminosyrasekvensen i sin struktur, har var och en av kedjorna en variabel region och en konstant region.
Tunga kedjor
De tunga kedjorna av immunglobuliner motsvarar polypeptidenheter bestående av 440 aminosyrasekvenser.
Varje immunoglobulin har två tunga kedjor, och var och en av dessa har en variabel region och en konstant region. Det konstanta området har 330 aminosyror och variabeln 110 aminosyror sekvenserade.
Strukturen för den tunga kedjan är annorlunda för varje immunglobulin. De är totalt 5 typer av tunga kedja som bestämmer vilka typer av immunoglobulin.
Tunga kedjetyper identifieras med de grekiska bokstäverna y, μ, a, ε, Δ för IgG, IgM, IgA, IgE och IgD -immunoglobuliner, respektive.
Det konstanta området med tunga kedjor ε och μ bildas av fyra domäner, medan de som motsvarar α, y, 5 har tre. Då kommer varje konstant region att vara annorlunda för varje typ av immunglobulin, men gemensamt för immunglobuliner av samma typ.
Kan tjäna dig: SternocleidohioidmuskelDen variabla regionen i den tunga kedjan bildas av en enda domän av immunglobulin. Denna region har en sekvens av 110 aminosyror och kommer att vara annorlunda beroende på antikroppens specificitet med ett antigen.
I strukturen på de tunga kedjorna kan en vinkling eller flexion observeras - ett gångjärn - som representerar det flexibla området i kedjan.
Ljuskedjor
Ljuskedjorna av immunglobuliner är polypeptider som består av cirka 220 aminosyror. Det finns två typer av lätt kedja i människan: kappa (κ) och lambda (λ), den senare med fyra undertyper. De konstanta och variabla domänerna har sekvenser av 110 aminosyror vardera.
En antikropp kan ha två ljuskedjor κ (κκ) eller ett par λ -kedjor (λλ) men det är inte möjligt att ha en av varje typ samtidigt.
FC- och FAB -segment
Eftersom varje immunglobulin har en form som liknar en "Y" kan delas upp i två segment. Det "lägre" segmentet, basen, kallas kristalliserbar fraktion eller FC; Medan armarna på "y" bildar fab, eller fraktionen som förenar antigenet. Var och en av dessa strukturella sektioner av immunglobulin utför en annan funktion.
FC -segment
FC -segmentet har två eller tre konstant domäner av de tunga kedjorna av immunglobulin.
FC kan förena proteiner eller en specifik mottagare i basofiler, eosinofiler eller kornceller, så det inducerar det specifika immunsvaret som kommer att eliminera antigenet. FC motsvarar karboxyländen av immunglobulin.
Fab segment
Fraktionen eller det fab -segmentet av en antikropp innehåller de variabla domänerna i dess ändar, utöver de ständiga domänerna för de tunga och lätta kedjorna.
Den ständiga domänen i den tunga kedjan fortsätter med domänerna för FC -segmentet som bildar gångjärnet. Det motsvarar den aminoterminala änden av immunglobulin.
Betydelsen av Fab -segmentet är att det tillåter förening med antigener, konstiga och potentiellt skadliga ämnen.
De variabla domänerna för varje immunglobulin garanterar deras specificitet med ett givet antigen; Denna funktion tillåter till och med användning vid diagnosen inflammatoriska och infektionssjukdomar.
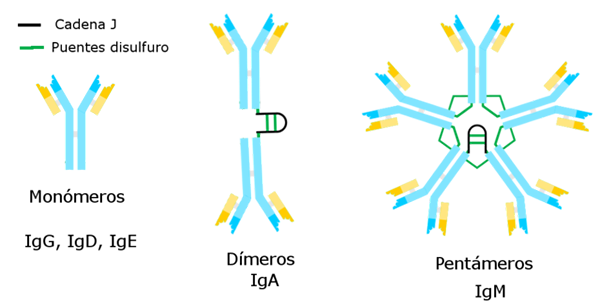
Typer av immunglobuliner
 Av Alejandro Porto [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)], via Wikimedia Commons
Av Alejandro Porto [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)], via Wikimedia Commons Immunoglobuliner hittills har en specifik tung kedja som är konstant för var och en av dessa och skillnaden från de andra.
Det finns fem sorter av tunga kedjor som bestämmer fem typer av immunglobuliner, vars funktioner är olika.
Immunoglobulin G (IgG)
Immunoglobulin G är den mest många sorten. Den har en tung gammakedja och presenteras i en unimolekylär eller monomer form.
IgG är det vanligaste i både blodserum och i vävnadsutrymmet. Minsta förändringar i aminosyrasekvensen i dess tunga kedja bestämmer deras uppdelning i subtyper: 1, 2, 3 och 4.
Kan tjäna dig: sarkomroImmunoglobulin G har en sekvens av 330 aminosyror i sitt FC -segment och en molekylvikt på 150 000, varav 105 000 motsvarar dess tunga kedja.
Immunoglobulin M (IgM)
Immunoglobulin M är en pentage vars tunga kedja är μ. Molekylvikten är hög, cirka 900 000.
Aminosyrasekvensen i dess tunga kedja är 440 i sin FC -fraktion. Det är främst i blodserum, vilket representerar 10 till 12 % av immunglobuliner. IgM har en enda subtyp.
Immunoglobulin A (IgA)
Den tunga kedjan a motsvarar den och representerar 15 % av de totala immunglobulinerna. IGA finns i både blod och utsöndringar, även i bröstmjölk, i form av en monomer eller dimer. Molekylvikten för detta immunglobulin är 320 000 och har två subtyper: IgA1 och IgA2.
Immunoglobulin E (IgE)
Immunoglobulin E består av den tunga kedjetypen och är mycket knapp i serum, cirka 0,002 %.
IgE har en molekylvikt på 200 000 och finns som en monomer huvudsakligen i serum, nässlem och saliv. Det är också vanligt att hitta detta immunglobulin inom basofiler och mastceller.
Immunoglobulin D (IGD)
Den tunga kedjan sorten Δ motsvarar immunglobulin D, som representerar 0,2 % av de totala immunoglobulinerna. IgD har en molekylvikt på 180 000 och är strukturerad i form av en monomer.
Det är relaterat till B -lymfocyter, fäst vid ytan på dessa. IgD: s funktion är dock inte klar.
Typändring
Immunoglobuliner kan uppleva en strukturell förändring av typen på grund av behovet av försvar mot ett antigen.
Denna förändring beror på funktionen av B -lymfocyter av tillverkning av antikroppar genom adaptiv immunitetsegenskap. Den strukturella förändringen är i det ständiga regionen i den tunga kedjan utan att förändra den variabla regionen.
En klass- eller klassändring kan leda till att ett IgM passerar till IgG eller IgE, och detta inträffar som ett inducerat svar från Gamma Interferon eller IL-4 och IL-5 interleuciner.
Funktioner av immunglobuliner
Den roll som immunglobuliner spelar i immunsystemet är av avgörande betydelse för att försvara organismen.
Immunoglobuliner är en del av det humorala immunsystemet; Det vill säga de är ämnen som utsöndras av celler för skydd mot patogener eller skadliga medel.
De ger ett effektivt sätt att försvar, effektiv, specifik och systematiserad, vara av stort värde som en del av immunsystemet. De har allmänna och specifika funktioner inom immunitet:
Allmänna funktioner
Antikroppar eller immunglobuliner uppfyller både oberoende funktioner och aktiverande effektor och sekretoriska svar medierade av celler.
Antigen-Aanticuerpo Union
Immunoglobuliner har funktionen att förena antigeniska medel specifikt och selektivt.
Bildningen av antigen-antikroppskomplexet är huvudfunktionen för ett immunglobulin och är därför det immunsvaret som kan stoppa antigenverkan. Varje antikropp kan gå med två eller flera antigener samtidigt.
Kan tjäna dig: alveolärt benEffektiva funktioner
Oftast fungerar antigen-antikroppskomplexet som en början för att aktivera specifika cellulära svar eller starta en sekvens av händelser som bestämmer eliminering av antigenet. De två vanligaste effektens svar är cellförening och komplementaktivering.
Cellularföreningen beror på närvaron av specifika receptorer för immunglobulin FC -segmentet, när det har anslutit sig till antigenet.
Celler som mastceller, eosinofiler, lymfocytbasofiler och fagocyter har dessa receptorer och ger antigen eliminationsmekanismer.
Aktiveringen av komplementvattenfallet är en komplex mekanism som involverar början av en sekvens, så det slutliga resultatet är utsöndring av toxiska ämnen som eliminerar antigener.
Specifika funktioner
Först utvecklar varje typ av immunglobulin en specifik försvarsfunktion:
Immunoglobulin g
- Immunoglobulin G ger de flesta försvar mot antigena medel, inklusive bakterier och virus.
- IgG -aktiva mekanismer som komplement och fagocytos.
- Den specifika IgG -konstitutionen för ett antigen är hållbart.
- Den enda antikroppen som mamman kan överföra till barn under graviditeten är IgG.
Immunoglobulin m
- IgM är den snabba svarsantikroppen före skadliga och smittsamma medel, eftersom den ger omedelbara åtgärder tills det ersätts av IgG.
- Denna antikropp aktiverar cellulära svar införlivade i membranet av humorala lymfocyter och svar som komplement.
- Det är det första immunglobulinet som syntetiserar människan.
Immunoglobulin a
- Det fungerar som en försvarsbarriär mot patogener, när det ligger på ytorna på slemhinnan.
- Det finns i andningsslemhinnan, matsmältningssystemet, urinvägar och även i utsöndringar som saliv, nässlemhinnor och tårar.
- Även om dess komplementaktivering är låg kan den vara förknippad med jämnhet för att eliminera bakterier.
- Närvaron av immunglobulin d både i bröstmjölk och i kalosteren gör det möjligt för en nyfödd att förvärva det under amning.
Immunoglobulin E
- Immunoglobulin och ger en stark försvarsmekanism mot allergiproducenter som producerar.
- IgE -interaktion och ett allergen kommer att göra inflammatoriska ämnen ansvariga för symtomen på allergier, såsom nysningar, hosta, bikupor, ökning av tårar och nässlem.
- IgE kan också kopplas till ytan av parasiterna genom dess FC -segment, vilket ger en reaktion som ger döden av dessa.
Immunoglobulin D
- Den monomera strukturen för IgD är kopplad till B -lymfocyter som inte har interagerat med antigener, så de utför receptorfunktionen.
- IGD: s funktion är oklar.

