Adsorptionsisotermerkoncept, typer, exempel

- 2833
- 251
- Anders Svensson
De Adsorptionsisotermer De är grafiska representationer av beteendet hos en adsorberad partikel, på ytan av en fast eller vätska, när dess koncentration ökas. Om de adsorberade partiklarna motsvarar en gas, beaktas dess tryck.
Genom att observera denna isoterm kan en idé om hur adsorptionsprocessen äger rum. Och därför, hur är partikelytan interaktioner och ytegenskaper. Analysering av isoterm dras om ytan är slät, porös eller mikroporös, såväl som möjliga kondensationer.
 Komponenter som är nödvändiga för graf eller konstruktion av adsorptionsisotermer. Källa: Gabriel Bolívar.
Komponenter som är nödvändiga för graf eller konstruktion av adsorptionsisotermer. Källa: Gabriel Bolívar. Den överlägsna bilden hjälper till att klargöra ovannämnda. De adsorberade partiklarna (lila cirklar) är de så kallade adsorbaten. Medan adsorbenten är den som har ett område där adsorbaten kommer att adsorberas. När ditt tryck eller koncentration ökar, desto större är den adsorberade volymen över adsorbenten.
Denna enkla representation motsvarar en adsorption som beskrivs av typ I -isoterm. Med hjälp av isotermer studeras adsorptioner av gaser eller flytande oändlighet på geler, fasta ämnen eller katalysatorer.
[TOC]
Typer av adsorptionsisotermer
 Adsorptionsisotermer för gas-fasta system. Källa: Daniele Pugliesi/CC BY-S (https: // Creativecommons.Org/licenser/BY-SA/3.0)
Adsorptionsisotermer för gas-fasta system. Källa: Daniele Pugliesi/CC BY-S (https: // Creativecommons.Org/licenser/BY-SA/3.0) Fem av de viktigaste experimentella isotermerna som används av S visas ovan. Brunauer för att klassificera gasformiga partiklar på fasta ämnen. Var och en beskriver en annan adsorptionsprocess. Dessutom har var och en matematiska modeller som försöker härleda beteendet hos dess kurvor.
Indisty av vad som är enheterna eller variablerna som används i x (p/po) och y (x) axlarna, indikerar x -axeln hur mycket tryck eller omvandling av adsorbat "handlingar" på det fasta ämnet; Medan Y -axeln, säger hur mycket av det adsorbatet verkligen adsorberades på ytan av nämnda fasta eller adsorbent.
Det kan tjäna dig: kopparsulfat (CUSO4): Struktur, egenskaper, erhållning, användningNär vi rör oss till höger om x -axeln ser vi således hur mängden adsorberade partiklar ökar beroende på ökningen i deras tryck eller koncentrationer. Detta leder till ett maximalt, ett förfall, en dal, etc., att på något eller annat sätt tillåter att tolka hur adsorption sker.
Typ I -isoterm
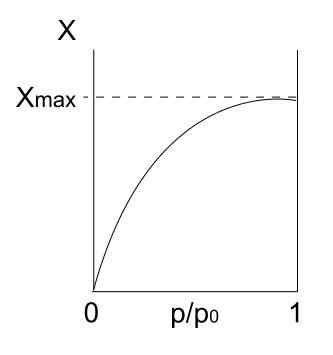 Typ I -isoterm. Källa: Daniele Pugliesi/CC BY-S (https: // Creativecommons.Org/licenser/BY-SA/3.0)
Typ I -isoterm. Källa: Daniele Pugliesi/CC BY-S (https: // Creativecommons.Org/licenser/BY-SA/3.0) Vi har typ I -isoterm ovan, som också kallas Langmuir -isoterm, eftersom dess modell förutspådde formen på denna kurva. Ser det, tolkas omedelbart att det finns en maximal mängd (xmax) av adsorberade partiklar, som inte kommer att variera oavsett hur mycket trycket ökar.
Detta maximala adsorptionsvärde kan bero på flera skäl. En av dem är att en kemisorction händer, vilket innebär att partiklar eller adsorbater är starkt bundna till ytan av det fasta eller adsorbentet. När det inte finns mer utrymme på ytan för att rymma fler partiklar kommer det inte att finnas mer adsorption.
Det sägs då att en monolager har bildats (till exempel de första bildens lila cirklar).
En annan anledning till att motivera isoterm av typ I är att en fisisorption inträffar, vilket innebär att interaktioner mellan partikelytor är mycket svaga (de innebär inte bildning av kemiska bindningar).
I detta fall slutar partiklarna in i Microporos, som en gång fylls, ytan kommer inte att ha fler platser för följande adsorationer; Det vill säga, det har lite externt område tillgängligt (som om det var ett mycket fint gitter). Detta beteende observeras när mikroporösa pulver analyseras.
Kan tjäna dig: kisel: historia, egenskaper, struktur, erhållning, användningTypisoterm Ii
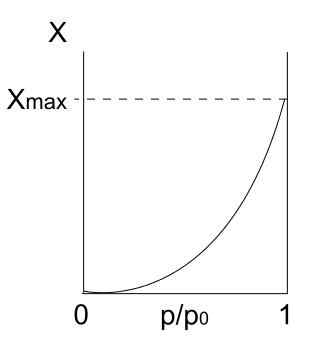
 Isoterm av typ II. Källa: Daniele Pugliesi/CC BY-S (https: // Creativecommons.Org/licenser/BY-SA/3.0)
Isoterm av typ II. Källa: Daniele Pugliesi/CC BY-S (https: // Creativecommons.Org/licenser/BY-SA/3.0) UP Vi har typ II -isoterm, även känd som sigmoid isoterm. Detta beskriver fysisprocesser för både icke -porösa fasta ämnen och makroporösa fasta ämnen.
Observera att det i början liknar den tidigare isoterm, vilket innebär att de adsorberade partiklarna bildar en monolager på adsorbentytan. När monolaget är redo kommer de andra partiklarna att adsorberas ovanpå det förra, vilket ger upphov till flerskikt. Detta är när vi ser den karakteristiska ökningen av denna isoterm (till höger).
En annan anledning till att typ II -isoterm erhålls beror på att partiklarna känner större affinitet för ytan än sig själva. Det vill säga monolaget (partiklar-superficie) kommer att vara mer stabil och varaktig än flerskikten (partiklar-partiklar) senare.
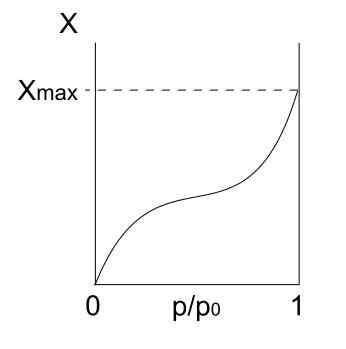
Typisoterm Iii
 Isoterm av typ III. Källa: Daniele Pugliesi/CC BY-S (https: // Creativecommons.Org/licenser/BY-SA/3.0)
Isoterm av typ III. Källa: Daniele Pugliesi/CC BY-S (https: // Creativecommons.Org/licenser/BY-SA/3.0) Typ III -isoterm liknar typ II när det gäller dess tolkning: Multicapas och Physis. Men den här gången är interaktioner mellan multicapas starkare än monolaget med ytan på det fasta ämnet. Därför är det en oregelbunden adsorption, med högar av adsorberade partiklar och fria ytdelar.
Typisoterm Iv
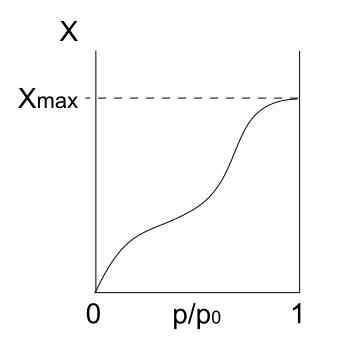 Isoterm av typ IV. Källa: Daniele Pugliesi/CC BY-S (https: // Creativecommons.Org/licenser/BY-SA/3.0)
Isoterm av typ IV. Källa: Daniele Pugliesi/CC BY-S (https: // Creativecommons.Org/licenser/BY-SA/3.0) Typ IV -isoterm beskriver också fisisorptions- och flerskiktsprocesser, ser ut som typ II -isoterm; Men nu, i porösa (och mesoporösa) fasta ämnen, där kondensationen av gasformiga partiklar är möjlig i små vätskevolymer. Tills poren med vätska är "täckt" kommer monoskiktet inte att vara komplett.
Kan tjäna dig: Matkemi: Studiefält, element, applikationerTypisoterm V
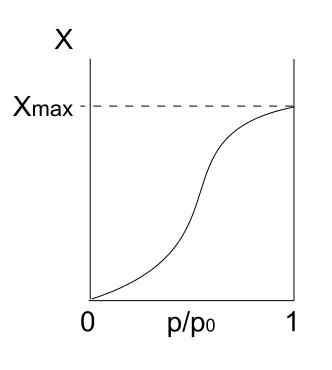 Typ V -isoterm. Källa: Daniele Pugliesi/CC BY-S (https: // Creativecommons.Org/licenser/BY-SA/3.0)
Typ V -isoterm. Källa: Daniele Pugliesi/CC BY-S (https: // Creativecommons.Org/licenser/BY-SA/3.0) Typ V -isoterm liknar typ IV, bara den här gången är formationerna av multicapas mer benägna än respektive mono -forpa. Det vill säga det liknar den adsorption som beskrivs av typ III -isoterm. Här når multicapa en maximal tjocklek, där det inte finns några platser för fler partiklar att adsorbera.
Exempel
Några exempel på gas-fasta system kommer att nämnas nedan bredvid den typ av isotermer som har erhållits i sina experimentella studier:
-Ammoniak-kol (typ I)
-Kväve-zeoliter (typ I)
-Väte-kol vid höga temperaturer (typ I)
-Kolsyrego (typ I)
-Kiseldioxidkväve (typ II)
-Kväve-hierro (typ II)
-Kiseldioxid bromo-gel (typ III)
-Kiseldioxidång (typ III)
-Kväve-politisk (typ III)
-Kripton-Negro av kol (typ IV)
-Bensen-gel av järnoxid (typ IV)
-Vattenånga-kol (typ V)
Observera att de nämnda fasta ämnena var kol, svart kol, metalliskt järn, järnoxid, zeoliter och kiseldioxidgel. Alla är bra exempel på adsorbenter med olika industriella tillämpningar.
Referenser
- Walter J. Moore. (1963). Fysisk kemi. I termodynamik och kemisk balans. (Fjärde ED.). Longmans.
- Iran. Levin. (2009). Principer för fysikalik. Sjätte upplagan, sidan 479-540. MC Graw Hill.
- Glanssten. (1970). Lärobok för fysisk kemi. Andra upplagan. D. Van Nostrand, Company, Inc.
- Enhet 3. Ytfenomen. (s.F.). Adsorption. [Pdf]. Återhämtat sig från: depa.Fquim.Unk.mx
- Lowell s., Shields J.OCH. (1984) Adsorptionsisotermer. I: Pulverytan och porositet. Springer, Dordrecht.
- Elsevier b.V. (2020). Adsorptionsisoterm. Vetenskaplig. Hämtad från: Scientedirect.com
- Wikipedia. (2020). Adsorption. Hämtad från: i.Wikipedia.org

