Joseph Thomson

- 2993
- 655
- Per Eriksson
 J.J. Thomson
J.J. Thomson Joseph John Thomson (1856-1940) Det var en brittisk kemist högt. Han vann Nobelpriset i fysik 1906.
Han föddes i Cheetam Hill, ett Manchester -distrikt, England, den 18 december 1856. Även känd som "J.J."Thomson studerade teknik vid Owens College, för närvarande en del av University of Manchester, och sedan matematik i Cambridge.
1890, j.J. Thomson gifte sig med Rose Elizabeth Paget, dotter till doktor Sir Edward George Paget, med vilken hon hade två barn: en tjej, med namnet Joan Paget Thomson, och ett barn, George Paget Thomson.
Det senare skulle bli en berömd forskare och fick 1937 ett Nobelpris i fysik för deras arbete med elektroner.
Från en ung ålder fokuserade Thomson sina studier på atomernas struktur och upptäckte därmed elektroner och isotoper, bland många andra av deras bidrag.
1906 fick Thomson Nobelpriset i fysik, "i erkännande av den stora förtjänsten av hans teoretiska och experimentella forskning om ledning av elektricitet genom gaser", som fastställts av juryn i domen för det ovannämnda priset.
1908 utnämndes han till riddare av den brittiska kronan och tjänade som hedersprofessor i fysik i Cambridge och Royal Institute, London.
Han dog den 30 augusti 1940 vid 83 års ålder i staden Cambridge, England. Fysikern begravdes i Westminster Abbey, nära Sir Isaac Newtons grav.
Joseph Thomson bidrag till vetenskap och kemi
Elektronupptäckt
1897, j.J. Thomson upptäckte en ny ljuspartikel än väte, som döptes "elektron".
Det kan tjäna dig: Bestämning av aska: Metoder och exempelVäte ansågs vara en atomviktsmätningsenhet. Fram till den tiden var atomen den minsta materiens uppdelning.
I detta avseende var Thomson den första som upptäckte de negativt laddade korpuskulära subatomära partiklarna.
Thomson Atomic Model
Thomsons atommodell var den struktur som den engelska fysikern tillskrivs atomer. För forskaren var atomer en positiv laddningsområde.
Det var inbäddade negativt distribuerade elektroner jämnt på det positiva belastningsmolnet, det vill säga neutralisera den positiva belastningen på atomdegen.
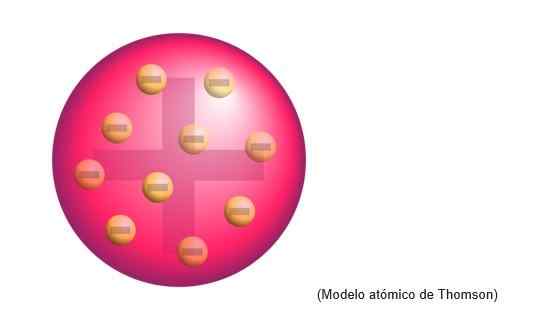
Denna nya modell ersätter det utarbetade av Dalton och kommer senare att motbevisas av Rutherford, Thomsons lärjunge i Cavendish Laboratories of Cambridge.
Atomerseparation
Thomson använde positiva eller anodiska strålar för att separera atomer från olika massa. Denna metod tillät honom att beräkna den elektricitet som transporteras med varje atom och antalet molekyler per kubikcentimeter.
Genom att kunna dela upp atomerna i olika massa och belastning upptäckte fysikern förekomsten av isotoper. Även på detta sätt, med sin studie av positiva strålar, producerade han stort framsteg mot masspektrometri.
Upptäckt av isotoper
J.J. Thomson upptäckte att neonjoner hade olika massor, det vill säga annorlunda atomvikt. Så här visade Thomson att neon har två undertyper av isotoper, Neon-20 och Neon-22.
Isotoperna, studerade fram till idag, är atomer i samma element, men deras kärnor har olika massantal, eftersom de består av olika mängder neutroner i deras centrum.
Experiment med katodstrålar
Katodstrålar är elektronströmmar i vakuumrör, det vill säga glasrör med två elektroder, en positiv och en negativ.
Kan tjäna dig: kromhydroxid: struktur, egenskaper, syntes, användningarNär den negativa elektroden värms upp, även kallad katod, avger den strålning som riktas mot den positiva elektroden, eller anod, i en rak linje om inget magnetfält inträffar i den vägen.
Om rörets glasväggar är täckta med fluorescerande material, producerar katodernas kupp mot det skiktet projicering av ljus.
Thomson studerade beteendet hos katodstrålar och anlände till slutsatserna att strålarna spred sig rakt.
Han drog också slutsatsen att dessa strålar kunde avledas från deras bana genom närvaron av en magnet, det vill säga av ett magnetfält. Dessutom kunde strålarna flytta bladen med styrkan hos elektronerna som cirkulerar, vilket visar att elektronerna hade massa.
J.J. Thomson upplevde gasen inuti katodstrålröret, men beteendet hos elektroner varierade inte. På samma sätt värmde katodstrålarna föremålen som placerades på vägen mellan elektroderna.
Sammanfattningsvis hade Thomson visat att katodstrålar hade ljusa, mekaniska, kemiska och termiska effekter.
Katodstrålarören och deras lätta egenskaper var transcendentala för efterföljande uppfinning av tub -tv (CTR) och videokameror.
Masspektrometer
J.J. Thomson skapade en första strategi för Masspektrometer. Detta verktyg tillät forskarstudien.
Med denna undersökning drog han slutsatsen att katodstrålarna bestod av negativa belastningskroppar, som är inne i atomerna, vilket postulerade atomens delbarhet och gav upphov till elektronfiguren.
Det kan tjäna dig: smörsyra: formel, egenskaper, risker och användningarFramstegen inom masspektrometri fortsatte också fram till idag och utvecklades i olika metoder för att skilja elektronerna från atomer.
Dessutom var Thomson den första som föreslog Den första vågguiden 1893. Detta experiment bestod av spridning.
Vågguider skulle användas i framtiden, även i dag, med dataöverföring och optisk fiber.
Thomsons arv
Thomson (TH) etablerades som en massbelastningsenhet i masspektrometri, föreslagen av kockar och rockwood-kemikalier, för att hedra Thomson.
Denna teknik gör det möjligt att bestämma fördelningen av molekylerna i ett ämne enligt deras massa och, erkänna av detta, som finns i ett urvalsprov.
Thomson Formula (TH):
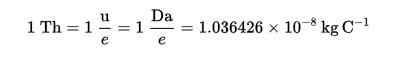
Enastående verk
- Avbrottet av elektricitet genom gaser, elektricitet genom gaser (1900).
- Korpuskulär teori om materia, elektronen i kemi och återkallelser och reflektioner (1907).
- Beyond the Electron (1928).
Referenser
- Nobel Media AB (2014). J. Thomson - Biografisk. Nobelpriset.org. Nobelpriset.org.
- Thomson, Joseph J., Elektricitet genom gasbeteende. Cambridge, University Press, 1903.
- Menchaca Rocha, Arturo. Den diskreta charmen hos elementära partiklar.
- Christen, Hans Rudolf, Grunder för allmän och oorganisk kemi, volym 1. Barcelona, Spanien. Utgåvor återställer.TILL., 1986.
- Arzani, Aurora Cortina, Grundskolan. Mexiko, Porrúa redaktion, 1967.
- R. G. Kockar, a. L. Stenved. Rapid Commune. Masspektrom. 5, 93 (1991).

