Laminina egenskaper, struktur, funktioner, typer
- 2704
- 616
- Johan Gustafsson
De Laminin Det är ett av proteinerna som utgör den extracellulära matrisen i basmembranet av epitelvävnader i ryggradsdjur. Denna typ av protein ger ett bindande stöd mellan konjunktiva vävnadsceller, så att de arbetar i sammanhållning och komprimering av dessa.
I allmänhet är lamininer ansvariga för att beställa det intrikata proteinnätverket som bildar den extracellulära matrisen eller basalvävnadsmembranet. Vanligtvis är lamininer associerade med proteiner såsom kollagen, proteoglykaner, entaktiner och hepar kommer att sulfat.
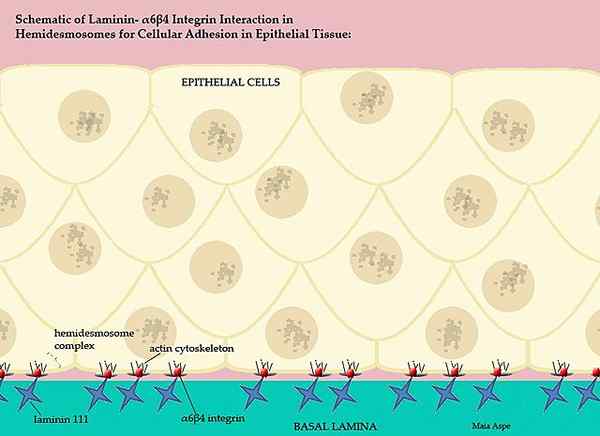
 Lamininer och deras deltagande i basal ryggradsmembran (källa: Maiaaspe/CC BY-S (https: // Creativecommons.Org/licenser/BY-SA/3.0) via Wikimedia Commons)
Lamininer och deras deltagande i basal ryggradsmembran (källa: Maiaaspe/CC BY-S (https: // Creativecommons.Org/licenser/BY-SA/3.0) via Wikimedia Commons) Detta intrikata basmembran, beställt av lamininerna, separerar epiteldelarna av vävnaderna, det vill säga varje extracellulär matris separerar endotelet från mesototio och den extracellulära matrisen i mesotelito separerar detta skikt från epiteliet.
Många undersökningar har visat att uttrycket av muterade lamininer gener är potentiellt dödligt för en cell, eftersom dessa också är ansvariga för att reglera nästan alla komplexa interaktioner som förekommer inom basmembranet.
Det finns en stor mångfald av lamininsfamiljer i alla ryggradsdjur. Dessa varierar i sammansättning, form, funktion och ursprung. Hos samma individ, i olika vävnader, kan olika lamininer hittas, var och en anpassad till vävnadens omgivningar som uttrycker den.
[TOC]
Laminina egenskaper
Lamininmonomerer eller enheter består av en annan glykoproteinkedjor Heterotromer. Dessa proteiner innehåller många olika domäner (multidominium) och är en väsentlig del av den tidiga embryonala utvecklingen av vävnader.
Den vanliga formen av lamininer är ett slags "kors" eller "y", även om vissa har en lång stapelform med fyra förgreningar. Denna lilla variation tillåter varje typ av laminin regelbundet den adekvata integrationen från alla positioner i vävnaden.
Det kan tjäna dig: p-nitrofenol: egenskaper, användningsområden och toxicitetLamininer har en hög molekylvikt, som kan variera beroende på typ av laminin, från 140 till 1000 kDa.
I allmänhet har varje basmembran en eller flera olika typer av lamininer inuti och vissa forskare föreslår att lamininer bestämmer en stor del av den fysiologiska funktionen hos basmembranen i vävnaden där de finns.
Hos ryggradsdjur har minst 15 olika typer av lamininer hittats, klassificerade i en familj, eftersom de bildas av samma trimmer, men med olika kombinationer. I ryggradslösa djur har de hittat mellan 1 och 2 olika trimrar.
Nuvarande studier tyder på att lamininer från alla ryggradsdjur uppstod genom differentiering av ortologer, det vill säga alla gener som kodar för lamininer har ett gemensamt ursprung från ryggradslösa djur.
Strukturera
Trots det stora antalet funktioner som reglerar lamininer har de en ganska enkel struktur som för det mesta bevaras bland de olika typerna som är kända.
Varje laminin består av tre olika kedjor sammanflätade med varandra och bildar en slags "sammanvävd fiber". Var och en av de tre kedjorna identifieras som Alfa (α), beta (ß) och gamma (y).
Bildningen av trimern för varje laminin beror på föreningen i den C-terminala regionen i var och en av dess kedjor. Inuti varje molekyl kopplas dessa kedjor genom peptidlänkar och tre disulfidbroar som ger strukturen ett stort mekaniskt motstånd.
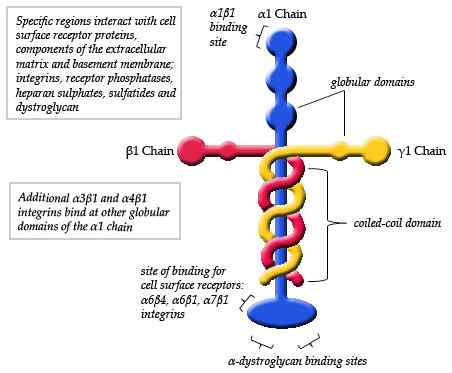 Schematiskt diagram över strukturen hos ett laminin (källa: Maiaaspe/CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/3.0) via Wikimedia Commons)
Schematiskt diagram över strukturen hos ett laminin (källa: Maiaaspe/CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/3.0) via Wikimedia Commons) Observationerna gjorda genom elektronisk mikroskopi av de typiska lamininmonomererna har detaljerat att strukturen är ett slags asymmetriskt kors som har en lång arm på cirka 77 nm (nanometrar) som kännetecknas av en framträdande kulform vid ett av dess ändar.
Kan tjäna dig: befolkningsdynamikDessutom observeras tre korta armar, två av cirka 34 nm och en av cirka 48 nm. Varje arm slutar vid en kula än, liknande huvudkedjan, men mindre i storlek.
Skillnaden mellan de olika typerna av lamininer beror främst på skillnader i a -kedjor, som kan vikas på minst tre olika sätt; Även om variationer för alla kedjor för närvarande har identifierats:
- 5 olika variationer eller kedjor av laminin a
- 3 variationer av ß -kedjor
- 3 variationer för y -kedjor
Funktioner
Den viktigaste och vanligt studerade funktionen av lamininer är interaktion med receptorerna som är förankrade i cellmembranen i cellerna intill basmembranen där dessa finns.
Denna interaktion gör att dessa proteiner är involverade i regleringen av flera cellulära aktiviteter och signalvägar. Det är att nämna att deras funktioner beror på deras interaktion med specifika receptorer på cellytan (många av membranreceptorerna klassificeras för närvarande enligt deras förmåga till förening till lamininer).
Integriner är receptorerna som interagerar med de "icke -integrerade" lamininer och receptorer är de som inte har förmågan att gå med i dessa proteiner. De flesta av de "icke -integrerade" receptorerna är proteoglykaner, vissa dystroglykaner eller syndecanos.
Mognaden av kroppsorganens vävnader äger rum med en ersättning av tidiga lamininer, som ursprungligen var inrymda i basmembranet i vävnaderna som bildade ungdomsorganen.
Inom lamininerna är den typ som har studerats mest laminin-1, som är direkt kopplad till tillväxten av axoner av praktiskt taget alla typer av neuron under förhållanden In vitro, Eftersom de reglerar rörelsen av "tillväxtkonen" på ytan av neuronerna.
Kan tjäna dig: urea buljong: vad är, grund, förberedelse, användningNomenklatur och typer
Biokemister betraktar familjen av lamininer som en mycket stor familj av protein, varav få av dess medlemmar fortfarande är kända. Moderna verktyg gör dock att nya typer av lamininer skymtar.
Sådana proteiner identifieras var och en med ett nummer, börjar med 1 som slutar numreringen i 15 (laminin-1, laminin-2 ... laminina-15).
En annan typ av nomenklatur används också, vilket indikerar vilken typ av kedja som varje laminin har. Till exempel består laminin -11 av en ALFA (a) -5 -kedja, med en betakedja (ß) -2 och med en gammakedja (y) -1, så den kan kallas laminina -521.
Dessutom klassificeras varje laminin enligt den funktion som är associerad med vilken den är associerad och även enligt den specifika kroppsvävnaden där den deltar. Några exempel på lamininer är:
- Lamina-1: som deltar i epitelutveckling
- Laminina-2: involverad i den myogena utvecklingen av alla vävnader, det perifera nervsystemet och glomerulusmatrisen.
- Lamina-3: Delta i mina tendensföreningar
- Lamina-4: fungerar i neuromuskulära fackföreningar och i den mesangiala matrisen i Glomeruli
- Laminina-5, 6 och 7: De verkar helst i epidermala vävnader.
Referenser
- Miner, J. H., & Yurchenco, s. D. (2004). Laminin fungerar i vävnadsmorfogenes. Annu. Varv. Cell dev. Biogus., 20, 255-284.
- Rasmussen, D. G. K., & Karsdal, M. TILL. (2016). Lamininer. I biokemi av kollagener, lamininer och elastin (PP. 163-196). Akademisk press.
- Sasaki, t., Fässler, r., & Hohenester och. (2004). Laminin: Källningsmembranmonteringens kärna. Journal of Cell Biology, 164 (7), 959-963.
- Timpl, r., Engel, J., & Martin, g. R. (1983). Multifunktionellt laminin-ett protein av källarmembran. Trender inom biokemiska vetenskaper, 8 (6), 207-209.
- Timpl, r., Rohde, h., Robey, s. G., Rennard, s. Yo., Foidart, j. M., & Martin, g. R. (1979). Laminin-a glykoprotein från källarmembran. Journal of Biologic Chemistry, 254 (19), 9933-9937.
- Tryggvason, k. (1993). Lamininfamiljen. Nuvarande åsikt i cellbiologi, 5 (5), 877-882.

