LDH -funktioner, bestämning, reaktion, normala värden
- 1010
- 162
- Johan Johansson
De laktatdehydrogenas, Mjölksyra-dehydrogenas, laktat NAD-beroende beroende eller helt enkelt LDH, är ett enzym som tillhör oxidorticas-gruppen som finns praktiskt taget i alla djurvävnader, grönsaker och i många mikroorganismer som bakterier, jästar och bågar och bågar.
Enzymer av denna typ betecknas med nummer EC 1.1.1.27 i den enzymatiska nomenklaturkommittén och ansvarar för reaktionen som omvandlar laktat till pyruvat (genom oxidation) och vice versa (genom reduktion), oxiderande eller reducerande dyukleotider av adenin nikotinamid (NAD+ och NADH) i processen känd som laktfermentation.
 Kristallin struktur av laktatdehydrogenas B (källa: BCDOYE [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] via Wikimedia Commons)
Kristallin struktur av laktatdehydrogenas B (källa: BCDOYE [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] via Wikimedia Commons) Till skillnad från alkoholhaltig jäsning, som endast förekommer i vissa mikroorganismer som jäst och användning.
Detta viktiga enzym för cellmetabolism kristalliserades från skelettråttmuskler på 1940 -talet och hittills är de bäst karakteriserade skelettmuskeln och hjärtvävnaden hos däggdjur.
I "överlägsna" djur använder enzymet laktatet L-isomer (L-laktat) för produktion av pyruvat, men några "lägre" djur och bakterier producerar D-laktat från pyruvatet erhållet genom glykolys.
Laktatdehydrogenas uttrycks vanligtvis mestadels i vävnader eller celler under anaeroba tillstånd (låg blodbevattning) som till exempel hos människor kan karakterisera patologiska tillstånd som cancer, lever eller hjärtförhållanden.
Konverteringen av pyruvatet till laktat är emellertid typisk för musklerna under övningen och hornhinnan i ögat, som är dåligt syresatt.
[TOC]
Funktioner
Laktatdehydrogenas möter flera funktioner på många metaboliska vägar. Det är mitten av den känsliga balansen mellan kolhydraternas kataboliska och anabola.
Under aerob glykolys, pyruvat (den sista produkten av rutten i sig) Det kan användas som ett substrat för de enzymatiska komplexa pyruvatdehydrogenas, av vilket det är dekarboxylerat, frigörande acetyl-CoA-molekyler som används nedströms, metaboliskt sett, i Krebs-cykeln.
I anaerob glykolys, tvärtom, producerar det sista steget av glykolys pyruvat, men detta används av laktatdehydrogenas för att producera laktat och NAD+, som återställer NAD+ som användes under reaktionen katalyserad av glyceraldehyd 3-fosfatdehydrogenas.
Liksom under anaerobios har den huvudsakliga källan för energiproduktion i form av ATP glykolys, laktatdehydrogenas har en grundläggande roll i reoxidationen av NADH som produceras i tidigare steg i den glykolytiska vägen, väsentligt för drift av andra relaterade enzymer.
Kan tjäna dig: tubulinLaktatdehydrogenas är också involverat i glykogenes som sker i vävnader som omvandlar laktat till glykogen och i vissa aeroba vävnader såsom hjärtat är laktat ett bränsle som återoxas för att producera energi och minska kraften i form av ATP och NAD+, respektive.
Egenskaper och struktur
Det finns flera molekylära former av laktatdehydrogenas i naturen. Endast hos djur har det fastställts att det finns fem aktiviteter laktatdehydrogenas, allt tetrameriskt och väsentligen sammansatt av två typer av polypeptidkedjor kända som underenheterna H och M (att kunna vara homo- eller heterotramérica).
H -formen är vanligtvis i hjärtstyg, medan M -formen har upptäckts i skelettmuskler. Båda kedjorna skiljer sig från varandra när det gäller överflöd, aminosyrasammansättning, kinetiska egenskaper och strukturella egenskaper.
H- och M -former är den translationella produkten från olika gener, eventuellt belägna i olika kromosomer, och som också är under kontroll eller reglering av olika gener. H -formen är dominerande i vävnader med aerob metabolism och M -formen i anaeroba vävnader.
En annan typ av nomenklatur använder bokstäver A, B och C för de olika typerna av enzymer hos både däggdjur och fåglar. Således är laktatmuskeldehydrogenas känt som4, hjärt som b4 och en tredje kallas c4, vilket är specifikt för testiklarna.
Uttrycket av dessa isoenzymer regleras både i en form av utvecklingsberoende och vävnadsberoende.
Enzymet har isolerats från olika djurkällor och det har fastställts att dess tetrameriska struktur har en genomsnittlig molekylvikt på cirka 140 kDa och att unionsplatsen för NADH eller NAD+ Den består av ett p-skalat ark bestående av sex kedjor och 4 alfa-propeller.
Bestämning
Efter spektrofotometri
Laktataktivitetsdehydrogenas av djurens ursprung är vissa spektrofotometriskt In vitro Genom färgförändringsmätningar tack vare oxidorReduction -processen som äger rum under laktatpyruvatomvandlingsreaktionen.
Mätningarna görs vid 340 nm med en spektrofotometer och hastigheten för minskning av optisk densitet på grund av oxidation eller "försvinnande" av NADH bestäms, som omvandlas till NAD+.
Det vill säga den beslutsamma reaktionen är som följer:
Pyruvate + nadh + h+ → Laktat + NAD+
Den enzymatiska mätningen bör utföras i optimala pH -förhållanden och koncentration av substrat för enzymet, så att risken för att underskatta mängden som finns i proverna på grund av substratunderskott eller genom extrema ytor eller basicitet inte körs.
Genom immunohistokemi
En annan metod, kanske något mer modern, för bestämning av närvaron av laktatdehydrogenas har att göra med användning av immunologiska verktyg, det vill säga med användning av antikroppar.
Kan tjäna dig: homologi (biologi)Dessa metoder drar nytta av affiniteten mellan föreningen mellan ett antigen med en antikropp som genereras specifikt mot det och är mycket användbara för snabb bestämning av närvaron eller frånvaron av enzymer såsom LDH i ett visst tyg.
Beroende på syftet måste de använda antikropparna vara specifika för detektering av någon av isoenzymerna eller för något protein med laktataktivitetsdehydrogenas.
Varför bestämma dehydrogenaslaktat?
Bestämningen av detta enzym utförs med olika syften, men främst för klinisk diagnos av vissa tillstånd, inklusive hjärtinfarkt och cancer.
På cellnivå har frisättningen av dehydrogenaslaktat betraktats som en av parametrarna för att bestämma förekomsten av nekrotiska eller apoptotiska processer, eftersom plasmamembranet blir permeabel.
Produkterna från reaktionen som katalyserar också kan bestämmas i ett tyg för att avgöra om en anaerob metabolism dominerar av någon speciell anledning.
Reaktion
Som initialt kommenterade, laktatdehydrogenas, vars systematiska namn är (S) -Laktato: nad+ dehydrogenas, katalyslaktatomvandling till en pyruvat+ beroende eller vice versa, som inträffar tack vare överföringen av en hydridjon (h-) Från pyruvaten till laktat eller från NADH till oxiderad pyruvat.
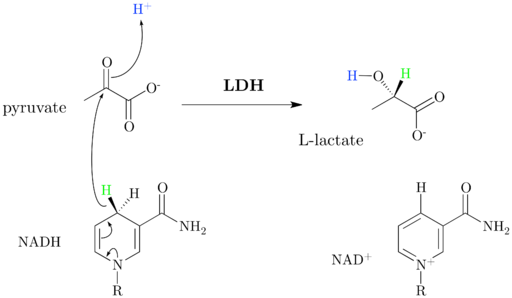 Schema och reaktionsmekanism för dehydrogenaslaktat (källa: Jazzlw [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] via Wikimedia Commons)
Schema och reaktionsmekanism för dehydrogenaslaktat (källa: Jazzlw [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] via Wikimedia Commons) Nad+ Den har en ADP -enhet och en annan nukleotisk grupp härrörande från nikotinsyra, även kallad niacin eller vitamin B3, Och detta koenzym deltar i flera reaktioner av stor biologisk betydelse.
Det är viktigt att lyfta fram att balansen i denna reaktion förflyttas till den sida som motsvarar laktatet och det har visats att enzymet också kan oxidera andra syror (S) -2 -hydroximonokarboxyl och användning, även om det är mindre effektivt, NADP+ som ett underlag.
Beroende på kroppsregionen som beaktas och samtidigt dess metaboliska egenskaper i förhållande till närvaro eller frånvaro av syre, producerar vävnaderna olika mängder laktat, produkten av reaktionen katalyserad av LDH.
Om till exempel en röd blodkropp (erytrocyt) som saknar mitokondrier som kan metabolisera den pyruvat som produceras under glykolys till CO2 Och vatten, då kan man säga att det är de viktigaste laktatproducerande cellerna i människokroppen, eftersom all pyruvat omvandlas till laktat genom verkan av dehydrogenaslaktat.
Å andra sidan, om levercellerna och cellerna i skelettmuskeln beaktas, är dessa ansvariga för produktionen av en minsta mängd laktat, med tanke på att detta snabbt metaboliseras.
Kan tjäna dig: Sabouraud Agar: Vad är, grund, förberedelse, användningNormala värden
Koncentrationen av laktatdehydrogenas i blodserum är produkten av uttrycket av flera isoenzymer i lever, hjärta, skelettmuskel, erytrocyter och tumörer, bland andra.
I blodserumet är de normala aktivitetsintervallen hos dehydrogenaslaktatet mellan 260 och 850 U/ml (enheter per milliliter), med ett medelvärde på 470 ± 130 U/ml. Samtidigt har blodhemoraliserade en LDH -aktivitet som varierar mellan 16.000 och 67.000 U/ml, vilket motsvarar i genomsnitt 34.000 ± 12.000 u/ml.
Vad betyder det att ha en hög LDH?
Kvantifieringen av koncentrationen av laktatdehydrogenas i blodserumet har ett viktigt värde i diagnosen viss hjärta, lever, blodsjukdomar och till och med cancerformer.
Hög LDH -aktivitetssiffror har hittats hos patienter med hjärtinfarkt (både experimentell och klinisk), liksom hos cancerösa patienter, särskilt hos kvinnor med endometrial cancer, äggstockar, bröst och livmoder.
Beroende på det speciella isoenzymet som är i "överskott" eller i en hög koncentration används kvantifieringen av isoenzymerna av dehydrogenaslaktatet av många behandlande läkare för bestämning av skador på vävnaderna (allvarliga eller kroniska).
Referenser
- Bergmeyer, h., Böjd, e., & Hess, f. (1961). Mjölkdydrogenas. Metoder för enzymatisk analys. Seelag Chemie, GmbH.
- Chung, f., TsujuBo, h., Bhattacharyya, u., Sharief, f., & Li, s. (1985). Genomisk organisation av humant laktatdehydrogenas-en gen. Journalbiokemisk, 231, 537-541.
- Becker, D. (2003). Mjölksyra. Intensivvårdsmed, 29, 699-702.
- Även J., & Kaplan, n. (1973). Laktat dehydrogenser: struktur och funktion. I Framsteg inom enzymologi och relaterade områden inom molekylärbiologi (PP. 61-133).
- Räv, s. Yo. (2006). Mänsklig psykologi (9: e upplagan.). New York, USA: McGraw-Hill Press.
- Huijgen, h., Sanders, G. T. B., Koster, r. W., Vreeken, J., & Bossuyt, s. M. M. (1997). Det kliniska värdet av laktatdehydrogenas i serum: en kvantitativ översyn. Eur J Clin Chem Clin Biochem, 35(8), 569-579.
- Nomenklaturkommittén för International Union of Biochemistry and Molecular Biology (NC-IBMB). (2019). Hämtad från www.Qmul.Växelström.Storbritannien/SBCS/IUBMB/enzym/index.Html
- Rawn, j. D. (1998). Biokemi. Burlington, Massachusetts: Neil Patterson Publishers.
- Usategui-gomez, m., Wicks, r. W., & Warshaw, m. (1979). Immunokemisk bestämning av hjärtisoenzymet av laktatdehydrogenas (LDH1) i humant serum. Kemhem, 25(5), 729-734.
- Wróblewski, f., & Ladue, J. S. (1955). Mjölkdydrogenasaktivitet i blod. Experimentell biologi och medicin, 90, 210-215.
- « Páramo -egenskaper, typer, flora, fauna, exempel
- Apolipoprotein och egenskaper, funktioner, sjukdomar »

