Leucinegenskaper, struktur, funktioner, biosyntes
- 4288
- 949
- Anders Larsson
De Leucin Det är en av de 22 aminosyrorna som utgör proteinerna från levande organismer. Detta tillhör en av de nio essentiella aminosyrorna som inte syntetiseras av kroppen och måste konsumeras med mat som intas i kosten.
Leucina beskrevs först 1818 av den franska farmaceuten och kemisten. L. Proust, som kallade det "oxidkantig". Senare förberedde Erlenmeyer och Kunlin den från a-bensoilamido-p-isopropilakrylsyra, vars molekylformel är C6H13NO2NO2.
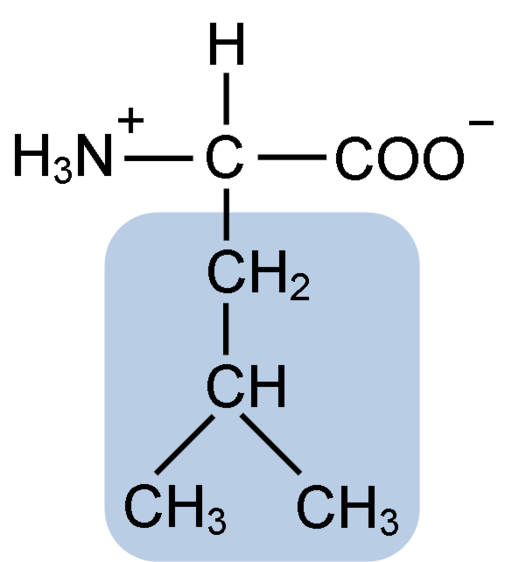
 Kemisk struktur av leucinaminosyran (fuen: Clavecin [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] via Wikimedia Commons)
Kemisk struktur av leucinaminosyran (fuen: Clavecin [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] via Wikimedia Commons) Leucin var nyckeln under upptäckten av känslan av proteinöversättning, eftersom dess hydrofoba struktur tillät biokemisten Howard dentzis att radioaktivt markera väte i kol 3 och observera betydelsen i vilken aminosyror införlivas i peptidsyntesen av hemoglobin.
Proteinerna som kallas "dragkedja" eller "stängningar" av Leucina är tillsammans med "zinkfingrarna", de viktigaste transkriptionsfaktorerna för eukaryota organismer. Leucin -blixtlås kännetecknas av deras hydrofoba interaktioner med DNA.
I allmänhet metaboliseras de proteiner som är rika på leucin eller som utgörs av grenade aminosyror inte i levern, istället går de direkt till musklerna där de snabbt används för proteinsyntes och erhåller energi.
Leucin är en aminosyra i grenad kedja som är nödvändig för biosyntes av proteiner och aminosyror av mjölk, som syntetiseras i bröstkörtlarna. Du kan hitta stora mängder av denna fria aminosyra inuti bröstmjölk.
Bland alla aminosyror som utgör proteiner är leucin och arginin de vanligaste och båda har upptäckts i proteinerna från alla riken som utgör livets träd.
[TOC]
Egenskaper
Leucin är känd som den essentiella aminosyran i grenad kedja, den delar den typiska strukturen med de andra aminosyrorna. Det kännetecknas emellertid eftersom dess sidokedja eller R -grupp har två kol som är länkade, och den sista är kopplad till en väteatom och två metylgrupper.
Det tillhör gruppen av polära aminosyror utan belastning, substituenter eller R -grupper av dessa aminosyror är hydrofoba och icke -polära natur. Dessa aminosyror är de viktigaste ansvariga för intra-proteiska hydrofoba interaktioner och tenderar att stabilisera proteinernas struktur.
Alla aminosyror, med ett centralt kol som är kiralt (kol a), det vill säga det har fyra olika förenade substituenter, de finns på två olika sätt i naturen; Således finns det D- och L-Leucina, den senare typiska i proteinstrukturer.
Båda formerna av varje aminosyra har olika egenskaper, deltar i olika metaboliska vägar och kan till och med modifiera egenskaperna hos de strukturer som de är en del av.
Till exempel har leucin i L-leucina en något bitter smak, medan den i sin D-leucinform är väldigt söt.
Formen av alla aminosyror är lättare att metabolisera vid däggdjurens kropp. L-Leucina är lätt att försämras och utnyttjas för konstruktion och skydd av proteiner.
Strukturera
Leucin består av 6 kolatomer. Det centrala kolet, vanligt i alla aminosyror, är kopplat till en karboxylgrupp (COOH), en aminogrupp (NH2), en väteatom (H) och en sidokedja eller R R -grupp sammansatt av 4 kolatomer.
Kan tjäna dig: mesotelioKolatomer inom aminosyror kan identifieras med grekiska bokstäver. Numreringen börjar från karboxylsyran (COOH) kol, medan anteckningen med det grekiska alfabetet börjar från det centrala kolet.
Leucin har som substituentgrupp i sin R-kedja R till en isobutyl- eller 2-metylpropilgrupp som produceras genom förlust av en väteatom, med bildandet av en alkylradikal; Dessa grupper förekommer som förgreningar i aminosyrastrukturen.
Funktioner
Leucin är en aminosyra som kan tjäna som ketogen föregångare för andra föreningar involverade i citronsyracykeln. Denna aminosyran representerar en viktig källa för syntesen av acetyl-CoA eller acetoacetyl-CoA, som är en del av bildningsvägarna för ketonkropparna i leverceller.
Det är känt att leucin är oumbärlig i insulinsignaleringsvägar, som deltar i början av proteinsyntesen och undviker förlust av protein på grund av nedbrytning.
Vanligtvis består de inre strukturerna hos proteiner av hydrofoba aminosyror såsom leucin, valin, isoleucin och metodin. Sådana strukturer bevaras vanligtvis för vanliga enzymer bland levande organismer, som i fallet med cytokrom c.
Leucin kan aktivera metaboliska vägar i bröstkörtelceller för att stimulera laktosyntes, lipider och proteiner som uppfyller funktioner såsom signalmolekyler i regleringen av energifostas av de unga hos däggdjur.
Leucinrika domäner är en väsentlig del av specifika DNA -bindande proteiner, som i allmänhet är strukturella diametrar på ett superregistrerat sätt och som kallas "leucine dragkedja proteiner".
Dessa proteiner har som en distinkt egenskap ett regelbundet mönster av upprepade leuciner tillsammans med andra hydrofoba aminosyror som är ansvariga för att reglera fackföreningarna av transkriptionsfaktorer till DNA och mellan olika transkriptionsfaktorer.
Leucin zip-proteiner kan bilda homo-eller heterodimerer som tillåter dem.
Biosyntes
Alla grenade aminosyror, inklusive leucin, syntetiseras huvudsakligen i växter och bakterier. I blommande växter finns det en betydande ökning av leucinproduktionen, eftersom det är en viktig föregångare för alla föreningar som är ansvariga för doften av blommor och frukt.
En av de faktorer som tillskrivs det stora överflödet av leucin i de olika bakteriella peptiderna är att 6 olika kodoner av den genetiska kodkodningen för leucin (UUA-uug-ucu-cua-cug), samma sak också gäller för argininin.
Leucin syntetiseras i bakterier från en femstegsväg som använder som utgångspunkt en ketacid relaterad till valinen.
Denna process regleras från alosteriskt, så att när det finns ett överskott av leucin inuti cellulärt, hämmar den enzymerna som deltar i rutten och stoppar syntesen.
Kan tjäna dig: Simpson Index: Formel, tolkning och exempelBiosintetisk väg
Biosyntesen av leucin i bakterier börjar med omvandlingen av en derivat ketacid i valin, 3-metyl-2-oxobutanoat i (2s) -2-isopropilmalat, tack vare verkan av enzymet 2-isopropilmalto-synta, som använder acetyl -COA och vatten för det ändamålet.
(2s) -2-isopropilmalaat förlorar en vattenmolekyl och förvandlas till 2-isopropilmaleat av 3-isopropylmalatdehydratas. Därefter lägger samma enzym till en annan vattenmolekyl och förvandlar 2-isopropilmaleato till (2R-3s) -3-isopropilm.
Den senare föreningen utsätts för en oxidorReduction-reaktion som förtjänar deltagande av en NAD+-molekyl, som producerar (2s) -2-isopropil-3-oxosuccination, vilket är möjligt med deltagandet av enzymet 3-isopropilmalato-delbrogenas.
(2s) -2-osopropyl-3-oxosuccination förlorar en kolatom i form av CO2 spontant, vilket genererar 4-metyl-2-oxopentanoatet som genom verkan av ett transaminas av grenade kedjaminosyror (transaminas leucin, specifikt)) Och med den samtidiga befrielsen av L-glutamat och 2-oxoglutarat, producerar det L-Leucina.
Degradering
Leucins huvudroll är att fungera som en signalering som berättar för cellen att det finns tillräckliga aminosyror och energi för att påbörja syntesen av muskelproteiner.
Nedbrytningen av grenade kedjaminosyror när leucin börjar med en transaminering. Detta och de två efterföljande enzymatiska stegen katalyseras av de tre enzymerna i fallet med leucin, isoleucin och valin.
Transamineringen av de tre aminosyrorna producerar a-ekotoacid-derivat av dessa, som är föremål för en oxidativ decarboxylering för att producera acyl-CoA-tioéer som är a, ß-dishydrenerade för att utföra tioéer de acil-CoA α, ß-omättade.
Under leucinkatabolism avslöjar motsvarande acyl-CoA-avslöjande, p-omättad p-insatura (HMG-CoA), som är mellanhand i kolesterolbiosyntes och andra isoprenoider.
Catabolic route of leucina
Från bildningen av acyl-CoA-farbror a, ß-ommättas som härrör från leucinet de kataboliska vägarna för denna aminosyra och valin och isoleucinavvakaren avsevärt.
Acyl-CoA-ucion a, p-omättad leucina bearbetas nedströms av tre olika enzymer kända som (1) 3-metylcrotonyl-CoA-karboxylas, (2) 3-metylglutaconil-CoA-hydratasa och (3) 3-hydroxi -3-metylglutariliska -COA LIASA.
I bakterier är dessa enzymer ansvariga för omvandlingen av 3-metylkrotonyl-CoA (leucinderivat) i 3-metylglutaconil-CoA, i 3-hydroxi-3-metylglutaril-CoA och i acetoacetat respektive acetyl-CoA.
Leucinet som finns i blodet utnyttjas för syntes av muskel/myofibrillärproteiner (MPS). Detta fungerar som en aktiverande faktor för denna process. Interagera också direkt med insulin och påverkar tillförseln av
Leucin rika livsmedel
Konsumtionen av rika aminosyraproteiner är nödvändig för den cellulära fysiologin för levande organismer och leucin är inget undantag bland essentiella aminosyror.
Proteiner erhållna från mejeriserum anses vara de rikaste i L-Leucina-rester. Men alla livsmedel med högt proteininnehåll som fisk, kyckling, ägg och rött kött ger stora mängder leucin för kroppen.
Kan tjäna dig: reproduktion av virus: faser och egenskaperMajs i spannmål är dåligt i lysin och tryptofan aminosyror, det har mycket styva tertiära strukturer för matsmältning och har lite värde från näringssynpunkt, men det har höga nivåer av leucin och isoleucin.
Frukten av baljväxter är rika på nästan alla essentiella aminosyror: lysin, treonin, isoleucin, leucin, fenylalanin och valin, men har lite innehåll i metod och cystein.
Leucin extraheras, renas och koncentreras i surfplattor som kosttillskott för idrottare med hög konkurrens och marknadsförs som ett läkemedel. Den huvudsakliga källan för isolering av denna aminosyran motsvarar soja sojamjöl.
Det finns ett näringstillskott som används av idrottare för muskelregenerering känd som BCAA (engelska "Grenad kedjaminosyra "). Detta ger höga koncentrationer av grenade kedjaminosyror: Leucina, Valina och isoleucin.
Fördelar med ditt intag
Leucin rika livsmedel hjälper till att kontrollera fetma och andra metaboliska sjukdomar. Många näringsläkare påpekar att livsmedel som är rika på leucin- och näringstillskott baserat på denna aminosyran bidrar till regleringen av aptit och ångest hos vuxna.
Alla leucin -rika proteiner stimulerar muskelproteinsyntes; Det har visats att en ökning av andelen intaget leucin med avseende på de andra essentiella aminosyrorna kan vända dämpningen av proteinsyntesen i muskulaturen hos äldre patienter.
Även personer med allvarliga makulära störningar som är förlamade kan stoppa förlusten av massa och muskelstyrka med rätt oral leucintillskott, förutom att tillämpa systemiska övningar av muskelmotstånd.
Leucin, valin och isoleucin är väsentliga komponenter i massan som utgör skelettmuskeln hos ryggradsdjur, så deras närvaro är avgörande för syntesen av nya proteiner eller för reparation av den befintliga existerande.
Brist
Bristerna eller missbildningar av a-zo-stoat dehydrogenas-komplexet, som är ansvarigt för att metabolisera leucin, valin och isoleucin hos människor, kan orsaka allvarliga psykiska störningar.
Dessutom finns det ett patologiskt tillstånd relaterat till metabolismen hos dessa grenade kedjaminosyror som kallas "Urinsjukdom med Arce Syrup Lukt".
Hittills har förekomsten av negativa effekter på överdriven leucinförbrukning inte visats. Emellertid rekommenderas en maximal dos på 550 mg/kg dagligen, eftersom det inte har funnits några långsiktiga studier relaterade till överdriven vävnadsexponering för nämnda aminosyra.
Referenser
- Álava, m. D. C., Camacho, m. OCH., & Delgadillo, J. (2012). Muskelhälsa och förebyggande av sarkopeni: Effekten av protein, leucin och ß-hydroxi-ß-metylbutirat. Ben- och mineralmetabolism tidningen, 10(2), 98-102.
- Fenhem, eller. R. (1993). Matkemi (Nej. 664: 543). Överklagande.
- Massey, L. K., Sokatch, j. R., & Conrad, r. S. (1976). Grenad kedja amininkatabolism i bakterier i bakterier. Bakteriologiska recensioner, 40(1), 42.
- Mathews, C. K., & Ahern, K. G. (2002). Biokemi. Pearson Education.
- Bara, a. (1999). Leucintillskott och intensiv träning. Sportmedicin, 27(6), 347-358.
- Munro, h. N. (Ed.). (2012). Däggdjursproteinmetabolism (Vol. 4). Annars
- Nelson, D. L., Lehninger, a. L., & Cox, M. M. (2008). Lehninger principer för biokemi. Macmillan.

