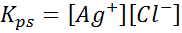Masslagslag

- 2048
- 488
- Hans Olsson
 En nederbördsreaktion involverar balans mellan löslighet, som styrs av massaktionslagen
En nederbördsreaktion involverar balans mellan löslighet, som styrs av massaktionslagen Vad är masåtagarlagen?
De Masslagslag säger att hastigheten på en reaktion beror på koncentrationen av dess reaktanter höjda till dess stökiometriska koefficienter. Denna lag gör det möjligt att relatera till varandra koncentrationerna i balansen mellan reaktanter och produkter från en reversibel kemisk reaktion. Med andra ord, det fastställer formeln för jämviktskonstanten.
Massaktionslagen uttalades av de norska (och grädde) kemisterna Cato M. Guldberg (1836-1902) och Peter Waage (1833-1900) 1864. Detta är en av de grundläggande lagarna om kemi, eftersom det gör att vi kan beräkna de slutliga koncentrationerna i jämvikt från de initiala mängderna.
Utöver detta tillåter masslagen också att vi lätt kan förstå effekterna av förändringar i koncentrationerna av någon av arterna på balans. Med andra ord, det gör att vi kan förstå hur Le Chatliers principer fungerar.
Trots att han kallas "Mass Action Law" hänvisar den inte riktigt till massorna av reaktanter och produkter, utan snarare till deras koncentrationer. Anledningen som kallas Mass Action Law och inte koncentrationslagen är att koncentrationen som brukade kallas "Active Mass".
Massaktionslagen och jämviktskonstanten
Enligt massåtgärdslagen, när reversibla reaktioner når balans beror det inte på att reaktionen stoppar. Tvärtom, balansen uppnås när hastigheten för den direkta reaktionen görs lika med hastigheten på den omvända reaktionen. När det händer förekommer och konsumeras alla kemiska arter med samma hastighet, så deras koncentrationer blir konstant (de slutar förändras).
Kan tjäna dig: toluen: struktur, egenskaper, användningar, erhållningGuldberg och Waage upptäckte att hastigheterna för båda reaktionerna (de direkta och det omvända) beror på den molära koncentrationen (i mol/L) på deras reagens höjda till de stökiometriska koefficienterna. Från dessa observationer lyckades de hitta formeln för jämviktskonstanten.
Enligt denna lag för alla reversibla kemiska reaktioner som når balans,
”... Förhållandet mellan produkten av de molära koncentrationerna av de produkter som tas upp till deras stökiometriska koefficienter och produkten av de molära koncentrationerna av de reaktanter som höjs till deras stökiometriska koefficienter är konstant vid en viss temperatur."
Denna konstant kallas "jämviktskonstant" och representeras med K -symbolenc.
Jämviktskonstantformeln
Låt oss se hur det föregående uttalandet ser ut i form av en matematisk ekvation. Det är en reversibel kemisk reaktion såsom den som presenteras nedan, där A och B är reaktanterna, C och D produkterna och A, B, C och D är respektive stökiometriska koefficienter för den balanserade reaktionen:
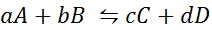
För en generisk reaktion som denna ges jämviktskonstanten av:
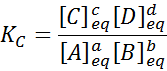
där [a], [b], [c] och [d] är de molära koncentrationerna av a, b, c och d i balans.
Balanskonstanten i tryck
Den tidigare formeln för jämviktskonstanten gäller för alla kemiska reaktioner där alla ämnen är i samma fas (det vill säga att de alla är i vattenfas, eller i en gasfas, till exempel). Men när det gäller gasfasreaktioner är det mer bekvämt att arbeta med tryck än med koncentrationer.
Eftersom den molära koncentrationen av gaser är proportionell mot deras partiella tryck, kan formeln för jämviktskonstanten skrivas om i termer av dessa tryck, enligt följande:
Det kan tjäna dig: 30 användningar av karboxylsyror i vardagen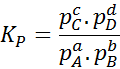
Där pTILL, pB, pC Och sD De är partiella tryck för A, B, C respektive D, och A, B, C och D förblir de stökiometriska koefficienterna. I det här fallet KP Det kallas konstantbalansen i tryck och är relaterad till kC Genom följande formel:
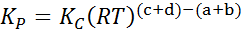
Där r är den universella konstanten av idealiska gaser och t är den absoluta temperaturen i Kelvin.
Reaktioner som involverar mer än en fas
Ibland involverar en kemisk reaktion bildning av ett fast ämne som en fällning från en lösning, eller bildandet av en vätska från reaktanter som reagerar i en gasfas. I dessa fall sker inte reaktionen i samma fas, så vi måste modifiera jämviktskonstantformeln.
Lyckligtvis är modifieringar mycket enkla. Det enda vi måste ta hänsyn till när vi skriver formeln för jämviktskonstanten är att de rena ämnena som visas som fasta ämnen eller vätskor inte bör ta hänsyn till dem. Vid behov placerar vi istället en 1.
Sammanfattningsvis tillåter massåtgärdslagen att skriva formeln för jämviktskonstanten både i koncentrationer och i partiellt tryck. Efter att ha känt en av de två kan den andra hittas från den första.
Slutligen måste vi vara försiktiga och granska den fas där alla kemiska arter finns för att veta om vi måste inkludera dem i jämviktskonstanten.
Exempel på användning av massåtgärdslagen
I följande exempel visar vi hur man använder Mass Action Law för att skriva formlerna för jämviktskonstanter för olika typer av kemiska reaktioner.
Reaktioner av reaktioner i gasformigt tillstånd
Exempel 1: Nedbrytningen av N2ANTINGEN4 i en gasfas
N2ANTINGEN4 Det är en brun gas som bryts ned enligt följande reaktion:
Det kan tjäna dig: láurinsyra: struktur, egenskaper, användningar, fördelar, effekter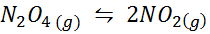
 NO2 -prov vid olika temperaturer som visar förskjutningen av balansen till den bruna N2O4
NO2 -prov vid olika temperaturer som visar förskjutningen av balansen till den bruna N2O4 För denna reaktion ges jämviktskonstanterna i koncentrationer och tryck av:
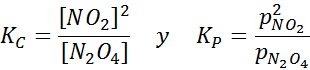
Exempel 2: Oxidationen av kolmonoxid
Kolmonoxid är en mycket toxisk gas som kan bli koldioxid när man reagerar med syre enligt följande reaktion:
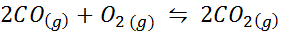
För denna reaktion ges jämviktskonstanterna i koncentrationer och tryck av:
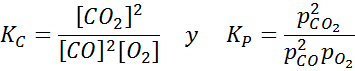
Syra-basbalanser i vattenfasen
Exempel 3: Vatten självlängd
Den joniska balansen mellan vatten, även känd som vattenlängdsreaktionen, är en reversibel reaktion mellan två vattenmolekyler i ett flytande tillstånd. Reaktionen är:
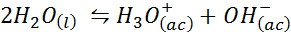
När vi skriver jämviktskonstanten för denna reaktion måste vi ta hänsyn till att det enda reagenset i detta fall är en ren vätska vars koncentration är praktiskt taget konstant. Av denna anledning ingår det inte i formeln för jämviktskonstanten:
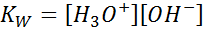
Detta är en mycket viktig jämviktskonstant som får sitt eget namn (konstant för den joniska produkten av vatten) och sin egen symbol (KW. W hänvisar till vatten på engelska, vilket sägs toalett). Det är emellertid en konstant av balans i koncentrationer som alla andra.
Löslighetsbalanser
Exempel 4: Silverkloridlöslighetsbalans
När vi förbereder en mättad lösning upprättas en löslighetsbalans. I detta fall är balansen för upplösningen av silverkloriden, vars reaktion ges av:
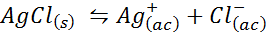
Jämviktskonstanten för denna reaktion (och alla lösningsreaktioner) inkluderar inte silverklorid (AGCL) eftersom det är ett fast ämne. Dessutom, som i fallet med vatten, får dessa konstanter också ett speciellt namn som är "konstant för löslighetsprodukten", representerad som K$: