Henrys lag

- 805
- 68
- Hans Olsson
 Henrys lag förklarar bruset av läskedrycker
Henrys lag förklarar bruset av läskedrycker Vad är Henrys lag?
De Henrys lag Det är förhållandet som beskriver effekten av tryck på gaslöslighet. Denna lag konstaterar att lösligheten för en gas i kontakt med ytan på en vätska vid en given temperatur är direkt proportionell mot det partiella trycket på nämnda gas på vätskan.
Detta innebär att ju större gastrycket på en vätska är, desto större är den totala mängden gas som kan lösas i den och därmed få en större koncentration (det vill säga desto större är lösligheten).
Henrys lag ser vi den i aktion varje gång vi avslöjar en sodavryck. Att vara stängd, högt tryck inuti flaskan håller kolsyren upplöst. Men genom att avslöja det minskar gastrycket, vilket minskar dess löslighet och flyr från bubblor och brusande.
Henrys lagformel
I matematisk form uttrycks Henrys lag som en proportionell lag:
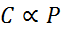
Denna proportionalitetslag förvandlas till:
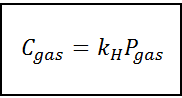
Var C Den hänvisar till den maximala koncentrationen av gas i vätskan, det vill säga dess löslighet; Pgas Det är det partiella gasen i kontakt med vätskan och kH Det är en proportionalitetskonstant som kallas Henrys lagkonstant.
Gaskoncentration kan uttryckas i olika enheter såsom molaritet, molitet eller molär fraktion. I de flesta fall använder emellertid kemikalier koncentration i molaritetsenheter (i mol/L), medan trycket uttrycks i atmosfärer.
Kan tjäna dig: Anthracene: Vad är, struktur, egenskaper, användningarKonstanten av Henrys lag (kH)
Konstanten kH Beskriv interaktioner mellan en gas och ett lösningsmedel. Ju starkare dessa interaktioner är, desto större är konstanten och därför desto större är lösligheten för gasen i lösningsmedlet vid en viss temperatur och tryck.
Numeriskt, värdet av kH representerar gasens löslighet vid den givna temperaturen, när det partiella trycket på samma är 1 atm.
Beroende på enheter av koncentration och tryck som används i ekvationen kan denna konstant ha mol/L -enheter.ATM, mol/kg.ATM, etc.
Följande tabell visar värdena på konstanten i Henrys lag för vissa vanliga gaser i vatten vid 25 ° C:

Dessa värden minskar med temperaturen, eftersom lösligheten hos gaser i allmänhet minskar vid en högre temperatur.
Förklaring av Henrys lag
Henrys lag är mycket lätt att förstå ur mikroskopisk synvinkel. Vi kan föreställa oss en gas som en uppsättning mycket små partiklar som studsar på alla ytor som spelar. När de kolliderar med ytan på en vätska kommer vissa partiklar att studsa, medan andra kommer att korsa ytan som fångas (det vill säga de kommer att lösa upp).
Detsamma gäller för gaspartiklar som är upplöst. De studsar med väggarna i behållaren och kan också nå vätskans yta, där vissa kommer att studsa medan andra kommer att korsa ytan och fly till gasfasen.
När balansen uppnås är hastigheterna med vilka gasen upplöses i lösningsmedlet och som det undgår dem lika, så att koncentrationen förblir konstant.
Kan tjäna dig: Metallers mekaniska egenskaper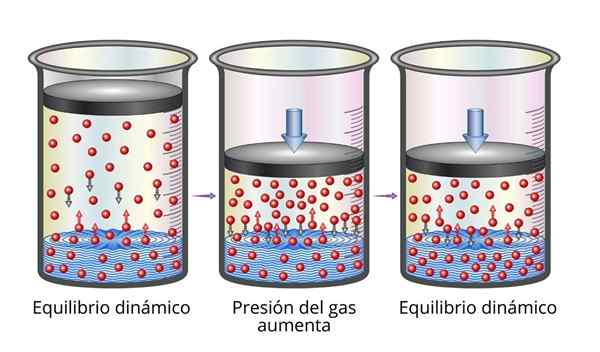 Förklaring av Henrys lag
Förklaring av Henrys lag När vi ökar gastrycket är det vi gör att öka frekvensen med vilken gaspartiklar kolliderar med vätskan ytan. Detta gör hastigheten med vilken gasen upplöses ökar. När en ny balans uppnås kommer den nya koncentrationen av gas att bli större.
Undantag från Henrys lag
Det är viktigt att lyfta fram att Henrys lag är en idealisk lag, som bara beskriver beteendet hos verkliga gaslösningar under vissa förhållanden. Således kan Henrys lag endast tillämpas när:
- Temperaturen förblir konstant.
- Gasen är i balans med lösningen.
- Gastrycket är relativt lågt.
- Gasen reagerar inte med lösningsmedlet.
Trots detta, även i vissa fall där gasen reagerar med lösningsmedlet, kan denna lag tillämpas ungefär.
Exempel på tillämpning av Henrys lag
Exempel 1: Bestämning av konstanten i Henrys lag
Det fastställdes experimentellt att koncentrationen av en vattenlösning i balans med neon vid ett tryck av 3,00 atm och 25 ° C är 0,00135 mol/L. Bestäm konstanten i Henrys lag för neon i vatten vid 25 ° C.
Lösning:
Enligt Henrys lag:
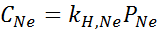
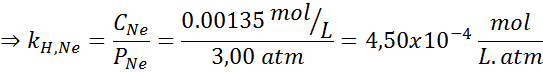
Därför är Henrys lagkonstant för neon i vatten vid 25 ° C 4,50 × 10-4 mol/l.Bankomat.
Exempel 2: Bestämning av lösligheten för en gas
Med hjälp av konstanten i Henrys lag som tillhandahålls i föregående tabell, bestäm lösligheten för koldioxid i luften i vatten vid havsnivån, och vet att den molära fraktionen av nämnda gas i luften är 3,14 × 10-4.
Lösning:
Vid havsnivån är lufttrycket 1 atm och CO: s partiella tryck2 Det ges av:
Det kan tjäna dig: Hypoyodous Acid (HIO)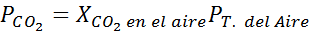
Ersätta detta uttryck i Henrys lag:
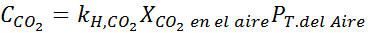
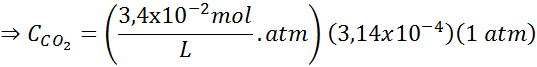
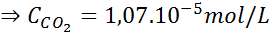
Exempel 3: Dykningsgaser
När en dykare ingenting på djup större än 30 meter, måste en blandning av luft andas med andra inerta gaser som helium eller argon, eftersom ökningen av kvävekoncentrationen i det förutsagda blodet genom Henrys lag har narkotiska effekter som orsakar desorientering, förvirring och syn problem.
Denna effekt börjar observera när andningsluften (xN2= 0,78) vid ett tryck på 4,00 atm. Om en dykare planerar att stiga upp till 100 meter djup, där trycket är cirka 11,0 atm, vad är den maximala kvävefraktionen som kan andas innan de lider av narkotikahandelare?
Lösning:
Baserat på uttalandet kan vi dra slutsatsen att den maximala koncentrationen av kväve är det som inträffar när lufttrycket är 4,00 atm. Enligt Henrys lag och att använda förhållandet mellan totalt tryck och partiellt tryck från föregående exempel:
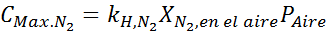
Detta måste vara samma maximala koncentration vid alla totala tryck. Så 100 meter:
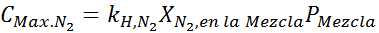
Utjämning av båda ekvationerna kan vi hitta den maximala molära fraktionen av kväve i blandningen:
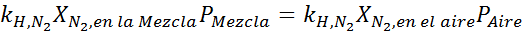
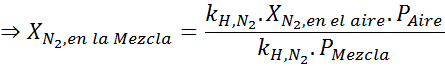
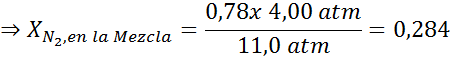
Detta innebär att dykaren inte ska använda en blandning som innehåller mer än 28,4% kväve om den planerar att dyka upp till 100 meter djup.

