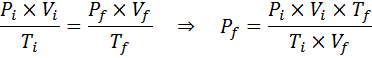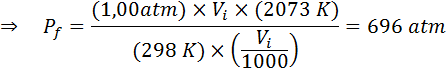Allmän gaslag

- 2169
- 50
- Hans Olsson
Vad är den allmänna gaslagen?
De Allmän gaslag, Ibland kallas även den kombinerade lagen om gaser, det är kombinationen av Boyle's Laws, Charles och Gay-Lussasasasasasasap. Det är en lag som beskriver förhållandet mellan trycket, temperaturen och volymen på en fast mängd av en idealisk gas.
Uttalandet av denna lag säger:
”Om antalet mol i en gas är konstant förblir förhållandet mellan tryckvolym och temperaturprodukten konstant."
I matematisk form uttrycks den allmänna lagen om gaser på följande sätt:
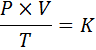
Där p representerar gasens tryck, v dess volym, t dess absoluta temperatur och k är en konstant för proportionalitet, vars värde beror på både mängden nuvarande gas och de enheter där de andra variablerna uttrycks.
Alternativa former av den allmänna gaslagen
Som proportionalitetslag
Ett alternativt sätt att uttala den allmänna lagen om gaser är i form av en proportionell lag:
"För varje fast mängd gas är produkten av dess tryck och dess volym direkt proportionell mot temperaturen".
Detta innebär att:
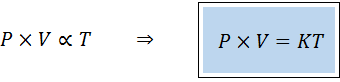
Detta motsvarar att multiplicera båda medlemmarna i den första ekvationen efter temperatur.
Förhållandet mellan det första och slutliga tillståndet
Liksom lagarna i Boyle, Charles och Gay-Lussac kan den allmänna gaslagen uttryckas som ett förhållande mellan det ursprungliga tillståndet och det slutliga tillståndet för en gas som genomgår en statlig förändring.
Till skillnad från de tidigare lagarna är det inte nödvändigt att ingen av de tre variablerna förblir konstant, bara antalet mol. Det vill säga att PXV/T -förhållandet kommer att vara detsamma i det ursprungliga tillståndet, Yo, Och i sluttillståndet, F. Med andra ord kan den allmänna gaslagen också uttryckas matematiskt som:
Det kan tjäna dig: Píchric Acid: Vad är, struktur, syntes, egenskaper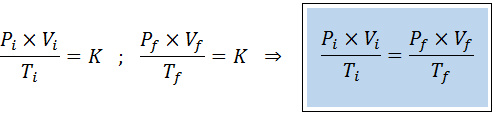
Härledning av formeln för den allmänna gaslagen
Som nämnts ovan kommer den allmänna gaslagen från kombinationen av Boyle, Charles och Gay-Lussacs lagar. Dessa lagar presenteras nedan:
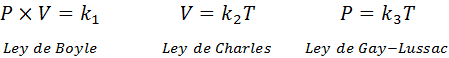
Om vi från var och en av dessa lagar rensar konstanten k, Och sedan multiplicerar vi dem med varandra, vi får:
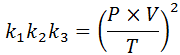
Nu, med kvadratroten i båda medlemmarna, erhålls den allmänna gaslagen:
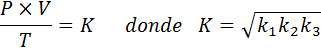
Den allmänna lagen om gaser vs. Lagen om de ideala gaserna
Lagen om allmänna gaser med den ideala lagen om gaser bör inte förväxlas. Trots att de är två mycket lika och också nära besläktade lagar, kombinerar den allmänna gaslagen endast lagarna om Boyle, Charles och Gay-Lussasac.
För sin del lägger den ideala gaslagen lagen till AVOGADRO -principen, enligt vilken "Lika volymer av olika gaser uppmätta under samma temperatur- och tryckförhållanden, innehåller samma antal partiklar ”.
Som en konsekvens, förutom att relatera temperatur, volym och tryck, tillåter lagen om idealisk också dessa variabler relaterade till antalet partiklar eller molens mol, så det representerar tillståndsekvationen för statusen för statusen Ideala gaser.
I följande ekvationer kan skillnaden mellan dessa två lagar lättare observeras:

Observera att den största skillnaden mellan båda lagarna är att den ideala gaslagen inkluderar n, som representerar antalet mol, och även istället för konstanten K, har Konstanten r som är konstanten för de ideala gaserna.
Kan tjäna dig: terpenosVi kan säga att den ideala gaslagen är mer allmän än den allmänna gaslagen, eftersom den kan tillämpas för någon mängd gas under någon uppsättning tryck, temperatur och volymförhållanden. Å andra sidan kräver tillämpningen av den allmänna gaslagen att mängden gas förblir konstant.
Exempel på tillämpningen av den allmänna gaslagen
Nedan följer några exempel på typiska problem där den allmänna gaslagen kan tillämpas:
Exempel 1: En luftbubbla under vattnet
Anta att en dykare som är på ett djup av 20 m under vatten där trycket är 3,00 atm och temperaturen är 15 ° C släpper ut en luftandedräkt och en av bubblorna har en initial volym på 100 cm3.
Bestäm volymen på luftbubblan när den når ytan som är i standardtemperatur- och tryckförhållanden, förutsatt att mängden luft inuti bubblan inte förändras när den stiger.
Lösning
Först måste vi extrahera all information från uttalandet. Det är underförstått att det finns två olika tillstånd för gas, en initial och ena änden, så vi separerar uppgifterna i två grupper. Det är också nödvändigt att konvertera temperaturer vid absolut temperatur:

Eftersom problemet anger att det inte finns någon förändring i mängden gas (luften) kan vi tillämpa den allmänna gaslagen, från vilken vi kan rensa den slutliga volymen:
Kan tjäna dig: Rodio: Historia, egenskaper, struktur, användningar, risk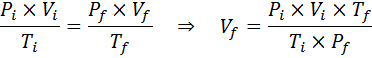
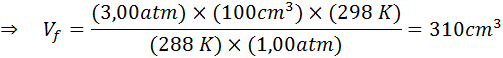
Därför når luftbubblan en volym av 310 cm3 När du når ytan.
Exempel 2: Högtryck
Hur mycket kommer trycket på en idealisk gas som är vid en omgivningstemperatur på 25 ° C och ett tryck på 1,00 atm och komprimera den tusendel av sin volym samtidigt värme upp till 1800 ° C i en förseglad behållare?
Lösning
Som tidigare börjar vi med att extrahera data:

Som det säger att processen genomförs i en förseglad behållare förändras inte mängden gas, så den allmänna gaslagen kan tillämpas: