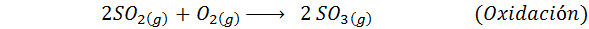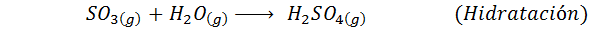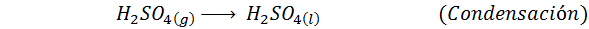Svavelsyra (H2SO4)

- 1346
- 141
- Anders Larsson
Vi förklarar vad svavelsyra, dess kemiska struktur, egenskaper, hur den erhålls, applikationer och risker är
 Svavelsyrebåtar (H2SO4)
Svavelsyrebåtar (H2SO4) Vad är svavelsyra?
han svavelsyra, Även kallad vätesulfat och vitriololja, det är en oxacidsvavelsyra som bildas av svavelanhydridreaktionen (så3) och vatten. Dess molekylformel är h2Sw4 Och det är överlägset den mest producerade och använda mineralsyra.
Det är en stark och mycket frätande mineralsyra som är blandbar med vatten så att den kan framställas i form av lösningar med nästan vilken koncentration som helst mellan 0 och cirka 18 molära.
De höga volymerna av produktion och konsumtion av denna förening beror på dess flera tillämpningar inom industrier så varierade som jordbruk, den petrokemiska industrin, i organisk och oorganisk syntes och i behandlingen av avloppsvatten, för att bara nämna några bara några några bara några.
Svavelsyrastruktur
Svavelsyra bildas av en central svavelatom med Valencia VI som är omgiven av 4 syreatomer, varav två är kopplade till väteatomer. Lewis -strukturen presenteras nedan:
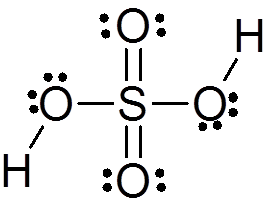
Som ni ser är svavel i denna förening omgiven av 12 elektroner (6 par), så det representerar ett av undantagen för oktettregeln.
Omgiven av 4 atomer förutspår teorin om avstötning av elektronpar av Valencia (Trepev) att denna förening måste anta en ungefär tetraedral geometri, som visas i följande bild:
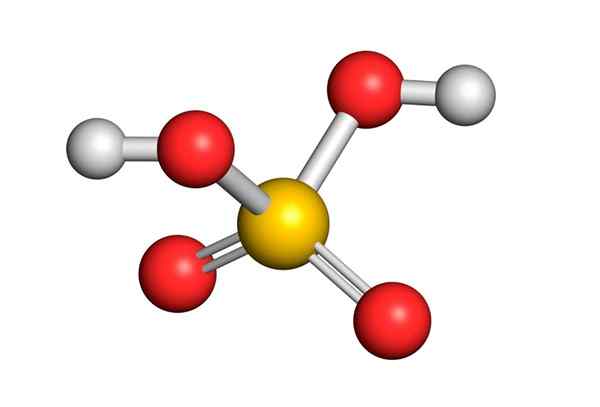
På grund av den höga elektronegativiteten hos syre och de olika resonansstrukturerna som svavelsyra kan ha, är bindningar mellan syre och hydrogener starkt polariserade, vilket gör dem mycket sura och enkla att dissociera hydrogener.
Svavelsyraegenskaper
Som en följd av dess struktur har svavelsyra följande fysiska och kemiska egenskaper:
Det kan tjäna dig: epoxid: nomenklatur, erhållning, applikationer, exempelFysikaliska egenskaper
- Ren svavelsyra är en färglös och toalettvätska som har en densitet på 1 8302 g/ml.
- Dess smältpunkt är 10,31 ° C och kokningen är 337 ° C, även om den vid den temperaturen tenderar att sönderdelas för att producera vatten- och svavelanhydrid (även kallad svaveltrioxid).
- Det är helt blandbart med vatten, så att du kan förbereda lösningar med valfri koncentration. Lösningar med mer än 98,3% i massan av denna syra är emellertid instabila och syra sönderdelas tills dess koncentration minskar till 98,3%. Denna lösning är stabil och är det som kallas koncentrerad svavelsyra.
- I sitt rena eller koncentrerade tillstånd är det en mer viskös vätska än vatten.
Kemiska egenskaper
- Ren svavelsyra är en starkt oxidant och frätande substans. Det har förmågan att oxidera, dehydrera och sulfonar till en mängd olika organiska föreningar och kolsyra andra.
- Det är en stark diplinsyra som helt tappar sin första proton genom att lösa upp i vatten och därmed bli dess konjugerade bas, den bisulfatjonen (HSO4-). Denna jon är också en syra, även om den är svagare än den ursprungliga syran.
- Vattenhaltiga svavelsyralösningar är starkt sura och kan lösa upp många metaller, vilket genererar gasformigt väte. De kan också helt neutralisera starka baser.
- Reagerar våldsamt med många alkoholer och vatten och släpper stora mängder värme i processen.
Hur erhålls svavelsyra?
De tre mest kända produktionsprocesserna för svavelsyran är: kontaktprocessen, den våta svavelsyran och processen för blykameror.
1. Svavelsyrasyntes av kontaktprocessen
Detta är den mest använda metoden idag för att producera svavelsyra. Processen består av 5 steg där elementärt svavel blir svaveldioxid (så2), sedan svaveltrioxid (så3), disulfurinsyra (h2S2ANTINGEN7) och slutligen i svavelsyra. De involverade reaktionerna är:
Kan tjäna dig: vad är säkerheten romb och vad är det för?
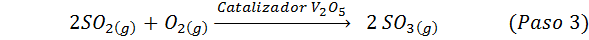


Det andra steget i processen består helt enkelt av rening av svaveldioxid innan den omvandlas till svavel- eller svavelanhydridtrioxid. Reaktionen från det tredje steget inträffar när den gasformiga svaveldioxiden kommer i kontakt med en solid vanadium -pentaoxidkatalysator (v2ANTINGEN5), Och det är därför metoden kallas kontaktprocessen.
2. Svavelsyrasyntes genom den våta processen
Denna process utformades för att rena utsläppsgaserna från en mängd olika kemiska industrier och växter. Biprodukten av denna rening är svavelsyra för kommersiell kvalitet utöver varmvattenånga, som kan återanvändas i den ursprungliga industriella processen.
När det gäller den våta processen är reaktionerna mestadels. De viktiga reaktionerna som inträffar i varje steg är:
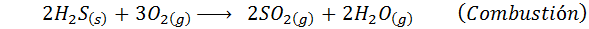
3. Svavelsyrasyntes genom processen med blykameror
Detta är en gammal metod för att producera svavelsyra som används idag mycket lite. Processen var att bränna elementärt svavel i närvaro av luft syre i blybelagda träkamrar, och därmed namnet.
Efter denna förbränning reagerar svaveldioxid sedan med kväveoxider producerade genom nedbrytning av natriumnitrat eller på annat sätt. I slutändan, efter en serie ytterligare reaktioner, erhölls svavelsyra.
Kan tjäna dig: platt bakgrundskolvGemensamma applikationer
- Huvudapplikationen av svavelsyra är som en källa till svavel i form av sulfater vid tillverkning av gödselmedel. Faktum är att cirka 60% av svavelsyra som produceras i världen är avsedd för detta ändamål.
- I den kemiska industrin används den för syntes av tvättmedel, pigment, katalysatorer för den petrokemiska industrin och för bearbetning av mineraler för att få olika metaller.
- Slutligen är svavelsyra den elektrolyt som används i blybatterierna som används i de flesta bilar.
Risker förknippade med svavelsyra
På grund av dess kemiska egenskaper kan svavelsyra vara mycket farliga för både människor och djur och miljön i allmänhet. Dessa är några av de risker som är förknippade med denna kemikalie:
- Dess frätande och uttorkande egenskaper gör att ren syra orsakar stor skada om den kommer i kontakt med huden.
- Å andra sidan genererar reaktionen av vattenhaltiga lösningar av svavelsyra med metaller gasformigt väte, vilket är ett bränsle och explosivt ämne.
- Svavelsyran i sig lider inte en förbränningsreaktion, men stimulerar förbränning av andra ämnen, fungerar som en slags katalysator, så den representerar en betydande brandrisk.
- Dessutom, när den utsätts för eld, kan den delas upp i toxiska gaser och generera svavelsyror som lätt kan förstöra luftvägarna.
Av dessa skäl och mer är svavelsyra ett ämne som bör hanteras noggrant.