Tunsen Munder -egenskaper, funktioner, exempel på användning

- 1849
- 528
- Hans Olsson
han Bunsen tändare Det är ett laboratorieinstrument som kan leverera en värmekälla effektivt och säkert genom en låga, som är en produkt av förbränning av en gas som vanligtvis är metan eller en blandning av propan och butan. Detta instrument i sig är synonymt med vetenskap och kemi.
Hans namn beror på den tyska kemisten Robert Bunsen, som var ansvarig, tillsammans med tränaren Peter Desa, för hans implementering och förbättring baserad på en modell som redan är designad av Michael Faraday. Denna tändare är liten och lätt, så den kan praktiskt tagas till alla platser där det finns en gasflaska och optimala anslutningar.
 Bunsen lättare uppvärmning av lösningen på en kolv. Källa: Sally V/CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/4.0)
Bunsen lättare uppvärmning av lösningen på en kolv. Källa: Sally V/CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/4.0) Tunsens tändare visas i aktion. Observera att scenariot inte ens är ett laboratorium. Flamen, blå, värmer kolven för att utveckla en kemisk reaktion, eller helt enkelt för att lösa upp en solid snabbare. Den huvudsakliga användningen av detta instrument är därför att helt enkelt värma upp en yta, prov eller material.
Bunsen -tändaren används emellertid också för en mängd olika metoder och processer, såsom flamstudie, sterilisering, destillation, förbränning och nedbrytning. Sedan gymnasiet har det varit orsaken till förvåning och rädsla bland studenterna att senare bli ett rutininstrument.
[TOC]
Historia
Ursprunget till detta ikoniska lättare datum tillbaka till 1854, i ett av laboratorierna vid University of Heidelberg, där Robert Bunsen arbetade. Då hade universitetets anläggningar redan ett mer rudimentärt gas och lättare rörsystem som de genomförde experiment.
Men dessa tändare, designade av Michael Faraday, genererade mycket ljusa och "smutsiga" lågor, vilket innebär att de deponerade på ytan som spelade kolfläckar. Dessa lågor, förutom att kamouflera färgerna som frigjorde vissa ämnen när de värmdes, var inte tillräckligt heta.
Således beslutade Robert Bunsen, tillsammans med den tyska tränaren, Peter Drag, att genomföra förbättringar i Faraday -tändare. För att uppnå detta sökte de att gasen brann med ett högre luftflöde, högre än den som fritt var runt laboratoriet. På detta sätt föddes Bunsen-Disaga-tändaren.
Sedan dess har laboratorier haft en tändare som gör att du kan få en mycket varmare och "ren" låga. Tack vare detta lättare inrättades stiftelserna eller ursprunget till spektroskopi.
Kan tjäna dig: karbonoider: element, egenskaper och användningarEgenskaper och delar av Tunsen tändare
- Instrument
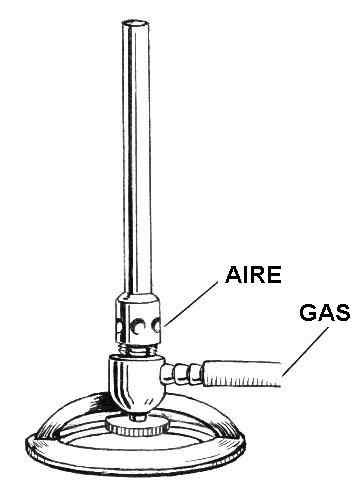 Ritning av delarna av bunsen tändare. Källa: Pearson Scott Foresman / Public Domain
Ritning av delarna av bunsen tändare. Källa: Pearson Scott Foresman / Public Domain I den överlägsna bilden har du en illustration av Tunsen tändare. De respektive posterna anges för både luft och gas.
Gasen går inuti en gummislang från gaskranen, belägen i samma laboratorieinställning, till den lättare ingången. I det lägre området på tändaren, precis ovanför det ringformade stödet, är en ventil eller hjul beläget som nivåer av gasflödet som kommer att vara utanför tändarens munstycke.
Luften, å andra sidan, kommer in i tändaren genom de cirkulära (eller rektangulära) hålen på halsbandet. När halsbandet är trasigt kommer mer luft att rinna in i hålen och blandas med gasen. Denna luftgasblandning kommer att stiga längs fatet eller kolonnen för att äntligen gå ut genom lättare munstycket.
Allt tändare som helhet är gjord av en lätt metall, såsom aluminium, och dess storlek är tillräckligt liten för att lagras på alla hyllor eller lådor.
- Samtal
Reduktor
 Flamen som erhållits av Bunsen -tändaren kan variera i färg beroende på mängden inkommande luft. Källa: Arthur Jankowski/CC BY-SA (http: // Creativecommons.Org/licenser/BY-SA/3.0/)
Flamen som erhållits av Bunsen -tändaren kan variera i färg beroende på mängden inkommande luft. Källa: Arthur Jankowski/CC BY-SA (http: // Creativecommons.Org/licenser/BY-SA/3.0/) När en värmekälla placeras precis på höjden av tändarens munstycke, oavsett om du använder en tänd eller en gnista, kommer luftgasblandningen att brinna och förbränning börjar. Det kommer att visas då lågan. Men de visuella och kemiska egenskaperna för denna låga beror på Aire-gasförhållandet.
Om halsbandet är stängt och förhindrar luften mellan dess hål kommer det att finnas en gasrik blandning, som kommer att brinna med syre från den omgivande luften. Denna låga motsvarar 1 (överlägsen bild) och är känd som flamman "säker" och "smutsig", för att vara den minst heta och den som också producerar den största mängden sot. Observera hur ljus det är och även dess gulorange färger.
Ljusen på denna låga beror på att sotpartiklarna, praktiskt taget består av kolatomer, absorberar värme och eld och färg och färg. Ju mer öppna gasingången, desto större kommer denna låga att vara.
Denna låga är också känd för att vara en reducerare, eftersom den ger kol som sotpartiklar, som kan minska vissa ämnen.
Oxidationsmedel
När halsbandet roterar, ökar hålen genom vilka luften öppnas, vilket ökar mängden luft i den resulterande gasformiga blandningen. Som ett resultat kommer den gula listan att bli mer och mer blåaktig (från 2 till 4), till en punkt där det kan verka transparent om blandningens bakgrund och renhet tillåter.
Kan tjäna dig: termisk: struktur, egenskaper, bildning, exempelFlame 4 är den mest önskade och användbara i laboratoriet, eftersom det är det hetaste och kan också perfekt oxidera provet som är placerat till din kontakt. Av denna anledning är denna låga känd genom att vara oxidant, eftersom förbränningsprodukter (i koldioxid och vattenånga) inte stör det omgivande syre och ämnen att oxidera.
Funktioner/användningar
 Belysning Tunsen tändare
Belysning Tunsen tändare Från föregående avsnitt kan man dra slutsatsen att lågan är det viktigaste elementet eller karakteristiskt för Bunsen -tändaren. Det är faktiskt som definierar respektive funktioner eller användningar av detta instrument, som kort sagt är inget annat än att värma en yta, material eller prov.
Detta betyder dock inte att det kan användas för att värma allt i laboratoriet. Till att börja med måste materialets smältpunkt vara över 1500 ºC, maximal temperatur som lågan kan nå. Annars skulle det smälta och orsaka en katastrof i Work Inn.
För det andra är flamtemperaturen så hög, att den kan sätta ångorna i alla organiska lösningsmedel, vilket skulle öka riskerna för eld. Därför bör endast vätskor med höga kokpunkter och låg volatilitet värmas.
Det är av detta skäl som vatten är ett exempel på en idealisk vätska för att värma genom användning av Bunsen tändare. Till exempel är det vanligtvis ofta att värma destillationsbollar, fälla ut kärl, kolvar eller krukor, som innehåller vattenhaltiga lösningar.
Använd exempel
Förbränning
En av de viktigaste användningarna av Bunsen -tändaren är att lämna in ett prov till förbränning; det vill säga oxidera det snabbt och exotermiskt. För att göra detta används oxidantflamman (blå och nästan transparent) och provet placeras i en behållare som en smältning.
Men de flesta prover flyttar därefter till en mufla, där du kan fortsätta värma upp i timmar (även för en hel dag).
Termisk nedbrytning
Som med förbränning, med bunsen tändare. Denna metod tillåter emellertid inte att den övervakas genom utvecklingen av nedbrytning när tiden sker.
Kan tjäna dig: dimetylanylin: struktur, egenskaper, syntes, användningFlamre repetition
Metalljoner kan detekteras kvalitativt genom flamtestning. För att göra detta läggs en tidigare uppvärmd och nedsänkt tråd i saltsyra i kontakt med provet och tas in i lågan.
De färger som är fristående hjälper till att identifiera närvaron av metaller som koppar (blåaktig grön), kalium (violet), natrium (intensiv gul), kalcium (orange röd), etc.
Sterilisering av material
Flamvärmen är sådan att den kan användas för en annan genial användning: för att förstöra mikroorganismer på materiens yta. Detta är särskilt användbart när man hanterar glas eller metaller som är avsedda för ändamål som är nära kopplade till hälsa (nålar, pipetter, hårbotten, etc.).
Destillering
Det sades tidigare att vatten är en av vätskorna som helst uppvärmda med Tunsen tändare. På grund av detta används det för att värma destillationsbollarna, och kokar därmed vattnet så att dess ångor drar vissa essenser eller dofter av växtmaterial (orange skal, kaneldamm, etc.).
Å andra sidan kan det också användas för att destillera andra typer av blandningar, förutsatt att flamens intensitet modereras och för många ångor genereras i processen.
Bestämning av kokpunkter
Med hjälp av Thiele -röret, olja, ett stöd och en capilla. Detta experiment är ganska vanligt när det gäller att undervisa laboratorier för allmän kemi och organisk kemi.
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan.). Cengage Learning.
- Wikipedia. (2020). Bunsenbrännare. Hämtad från: i.Wikipedia.org
- Ränta på ränta. (31 mars 2016). Kemihistoria: Bunsen Burner Day. Återhämtat sig från: sammansattning.com
- Nikki wyman. (31 augusti 2015). Bunsen Burner: Parts, Function & Diagram. Återhämtat sig från: studie.com
- Nichols Lisa. (18 augusti 2019). Bunsenbrännare. Kemi librettexts. Återhämtad från: kem.Librettexts.org
- Wayne State University. (s.F.). Korrekt användning av en Bunsen -brännare. [Pdf]. Återhämtat sig från: forskning.Wayne.Edu

