Metilaminstruktur, egenskaper, produktion, användningar
- 840
- 64
- Anders Larsson
De Metilamin Det är en organisk förening vars kondenserade formel är Cho3Nh2. Specifikt är det den enklaste primära alkyaminen av alla, eftersom den bara innehåller en alquilisk substituent, vilket är detsamma som att säga att det bara finns en C-N-kovalent länk.
Under normala förhållanden är det en ammoniakgas som luktar fisk, men som är relativt lätt att kondensera och transportera i hermetiska tankar. På samma sätt kan det upplösas märkbart i vatten, vilket orsakar gulaktiga lösningar. Å andra sidan kan det också transporteras som fast i form av ditt hydrokloridsalt, CH3Nh2· HCL.
 Metilaminmolekyl. Källa: Benjah-Bmm27 via Wikipedia.
Metilaminmolekyl. Källa: Benjah-Bmm27 via Wikipedia. Metilamin förekommer industriellt från ammoniak och metanol, även om det finns många andra produktionsmetoder på laboratorieskalor. Dess gas är mycket explosiv, så alla värmekällor nära den har potential att orsaka en stor eld.
Det är en förening med hög kommersiell efterfrågan, men samtidigt presenterar den starka lagliga begränsningar eftersom det fungerar som råmaterial för läkemedel och psykotropa ämnen.
[TOC]
Strukturera
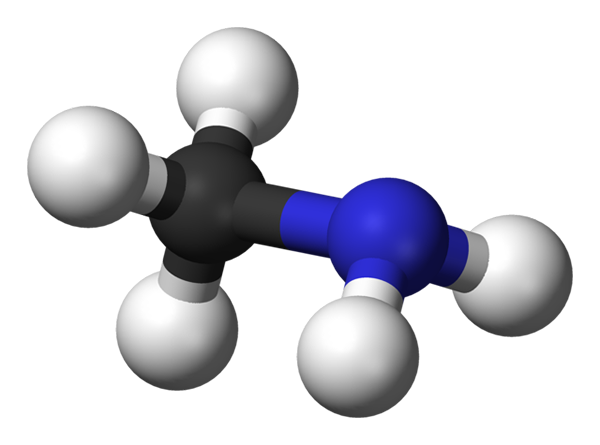
Bilden ovan visar molekylstrukturen hos metylamin som representeras av en modell av sfärer och staplar. Den svarta sfären motsvarar kolatomen, det blå till kväveatomen och det vita till väteatomerna. Det är därför en liten molekyl, där metan, Cho4, Förlora en H för en NH -grupp2, Givande Ch3Nh2.
Metilamin är en mycket polär molekyl, eftersom kväveatom lockar elektronisk koldensitet och väteatomer. Det har förmågan att också bilda vätebroar mellan kompendiet av dess intermolekylära krafter. Varje molekyl av CH3Nh2 Du kan donera eller acceptera en på varandra följande vätebro (ch3Hnh-nh2Ch3).
Kan tjäna dig: vad är bandteori?Emellertid är dess molekylmassa betydligt låg, utöver hamnarna Ch3 De hindrar sådana vätebroar. Resultatet är att metylamin är en gas under normala förhållanden, men som kan kondenseras vid en temperatur av -6 ºC. När det är kristalliserat gör det det efter en ortorrombisk struktur.
Egenskaper
Fysiskt utseende
Färgglad gas eller vätska, men vars vattenhaltiga lösningar kan presentera gulaktiga toner.
Lukt
Obehaglig, liknande den för en blandning av fisk och ammoniak.
Molmassa
31,058 g/mol
Smältpunkt
-93,10 ºC
Kokpunkt
Runt -6 ºC. Därför är det en gas som kan kondensera vid inte för kalla temperaturer.
Densitet
656,2 kg/m3 vid 25 ºC. Dess ångor är 1,1 gånger tät än luft, medan dess vätska eller kondensat är ungefär 0,89 gånger mindre tät än vatten.
Ångtryck
Vid rumstemperaturen sträcker sig ditt ångtryck 3,5 atm.
Dipolärt ögonblick
1,31 d
Vattenlöslighet
1.080 g/L vid 20 ºC. Det är en gas som löser upp mycket bra i vatten, eftersom båda molekylerna är polära och relaterade till varandra när man etablerar vätebroar (CH3Hnh-oh2).
Basicitet
Metilamin har en basicitetskonstant (PKb) av 3,36. Detta värde indikerar att det är ett betydligt grundläggande ämne, ännu mer än samma ammoniak, så det upplöstes i vatten släpper en viss mängd OH -joner- När hydrolysiserad:
Ch3Nh2 + H2Eller ⇌ ch3Nh3+ + Åh-
Metilamin är mer grundläggande än ammoniak eftersom dess kväveatom har större elektronisk densitet. Detta beror på att Cho3 Gjort mer kvävelektroner än de tre väteatomerna i NH -molekylen3. Trots detta betraktas metyilamin som en svag bas framför andra alkyaminer eller aminer.
Kan tjäna dig: CO2 -länktypFlashpoint
-10 ºC till en stängd kopp, vilket innebär att det är en mycket brandfarlig och farlig gas.
Självriktningstemperatur
430 ºC
Ytspänning
19,15 mn/m a 25 ºC
Sönderfall
När brännskador är det termiskt sönderdelat i kol- och kväveoxider, som bildar en toxisk rök.
Produktion
Metilamin kan produceras eller syntetiseras antingen med den kommersiella eller industriella metoden eller med laboratoriemetoder på lägre skalor.
Industriell
Metilamin förekommer industriellt genom reaktionen som äger rum mellan ammoniak och metanol på ett katalytiskt sympatiskt gelstöd. Den kemiska ekvationen för denna reaktion är som följer:
Ch3Oh + nh3 → Ch3Nh2 + H2ANTINGEN
Under processen kan andra alkaminer genereras; Men metyilamin är den produkt som filmiskt ser mer gynnad ut.
Laboratorium
På laboratorienivå finns det flera metoder som tillåter syntetisering av småskaliga metylamin. En av dem är reaktionen i ett starkt basmedium, av KOH, mellan acetamid och brom, under vilken metylisocianat genereras, CH3NCO, som i sin tur är hydrolyserad för att bli metylering.
Metilamin kan lagras som ett fast ämne om det neutraliseras med saltsyra, så att en hydrokloridsaltform bildas:
Ch3Nh2 + Hcl → ch3Nh2· HCL
Sedan metylaminhydroklorid, också representerad som [CH3Nh3] CL, kan baseras på en säker plats att få den vattenhaltiga lösningen med upplöst gas:
[Ch3Nh3] Cl + NaOH → CH3Nh2 + NaCl + H2ANTINGEN
Å andra sidan kan metylamin också syntetiseras från hexamin, (CH2)6N4, som är direkt hydrolyserad med saltsyra:
Kan tjäna dig: kristallisation(Ch2)6N4 + Hcl + 6 h2O → 4 NH4Cl + 6 ch2ANTINGEN
I följd reagerar ammoniumklorid med varm formaldehyd för att orsaka metyilamin och myrsyraångor, HCOOH.
Metylamin kan också erhållas genom att reducera nitrometan, CH3NEJ2 med metallisk zink och saltsyra.
Ansökningar
 Efedrin är en medicin som behöver metyilamin för kommersiell produktion. Källa: TurkeyPhant.
Efedrin är en medicin som behöver metyilamin för kommersiell produktion. Källa: TurkeyPhant. Metilamin är en förening vars användningar vanligtvis genererar kontroverser, eftersom det är ett ämne som används i narkotikasyntes som metamfetamin. Faktum är att dess popularitet beror på önskan att huvudpersonerna i Breaking Bad -tv -serien var tvungna att få det till varje pris.
Denna förening används också som råmaterial för produktion av insekticider, läkemedel, ytaktiva medel, sprängämnen, färgämnen, fungicider, tillsatser etc., Så det har en stark världsbehov, utöver flera lagliga begränsningar för förvärvet.
Dess enorma kemiska mångsidighet beror på dess CHO -molekyl3Nh2 Det är ett bra nukleofilt medel, kopplat eller koordinerat till underlag av större molekylmassa i flera organiska reaktioner. Till exempel är detta baserat på syntesen av efedrinen, där Cho3Nh2 Den går med i en molekyl med den därmed förlusten av en h.
Referenser
- Morrison, r. T. och Boyd, R, N. (1987). Organisk kemi. Femte upplagan. Redaktör Addison-Wesley Inter-American.
- Carey f. (2008). Organisk kemi. (Sjätte upplagan). MC Graw Hill.
- Graham solomons t.W., Craig b. Fryhle. (2011). Organisk kemi. (10: e upplagan.). Wiley Plus.
- Wikipedia. (2020). Metylamin. Hämtad från: i.Wikipedia.org
- Nationellt centrum för bioteknikinformation. (2020). Metylamin. Pubchemdatabas., CID = 6329. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Dylan Matthews. (15 augusti 2013). Här är vad "Breaking Bad" blir rätt och fel, om meth -företaget. Återhämtat sig från: washingtonpost.com
- Förskolning. (2020). Beredning av metylaminhydroklorid. Återhämtat sig från: prepchem.com

