Nitrilegenskaper, nomenklatur, användning, exempel

- 1314
- 328
- Prof. Erik Johansson
De Nitriler De är alla de organiska föreningarna som har CN -funktionsgruppen, som också kallas som en cyano -grupp eller cyanid när det gäller oorganisk kemi. Alifatiska nitriler representeras med RCN: s allmänna formel, medan aromatiska nitriler med ARCN -formeln.
Även om vätecyanid, HCN och liksom cyanidmetallsalter är mycket giftiga föreningar, händer exakt detsamma inte med nitriler. CN -gruppen i ett kolskelett av alla slag (grenade, linjära, aromatiska, etc.), det uppför sig diagonalt annorlunda från en cyanidanjon, CN-.
 Allmän formel för en alifatisk nitril. Källa: Benjah-Bmm27 via Wikipedia.
Allmän formel för en alifatisk nitril. Källa: Benjah-Bmm27 via Wikipedia. Nitriler är mycket spridda i plastvärlden, som flera av dem härstammar från akilonitril, ch2CHCN, en nitril med vilka polymerer syntetiseras såsom nitrilgummi, används för att göra kirurgi eller laboratoriehandskar. Nitriler finns också i många naturliga och farmaceutiska produkter.
Å andra sidan är nitriler föregångare till karboxylsyror, eftersom deras hydrolys representerar en alternativ syntesmetod för att erhålla den senare.
[TOC]
Egenskaper och egenskaper
Strukturera
De molekylära strukturerna i nitrilerna varierar beroende på identiteten för R eller AR i RCN respektive ARCN -föreningarna.
CN -gruppgeometri är emellertid linjär på grund av dess trippellänk, C≡N, som är produkten av SP -hybridisering. Således finns C-C≡N-atomer i samma linje. Utöver dessa atomer kan det finnas någon struktur.
Polaritet
Nitriler är polära föreningar, eftersom kväve i CN -gruppen är mycket elektronegativ och lockar elektroner mot sig själv. Därför har de fusions- eller kokpunkter högre än sina homologer till.
Det kan tjäna dig: Skandio: Historia, egenskaper, reaktioner, risker och användningarTill exempel acetonitril, cho3CN, det är en vätska som kokar vid 82 ºC; Medan etano, ch3Ch3, Det är en gas som kokar på -89 ºC. Notera den stora effekten som CN -gruppen har på intermolekylära interaktioner.
Samma resonemang gäller för större föreningar: om de har en eller flera CN -grupper i sin struktur är det ganska troligt att deras polaritet kommer att öka och vara mer relaterade till ytor eller polära vätskor.
Basicitet
Man kunde tänka på att på grund av nitrilernas höga polaritet är dessa relativt starka baser framför aminerna. Vi måste dock överväga C≡N -kovalenta bindningarna, och det faktum att både kol och väte har SP -hybridisering.
RCN: s basicitet: Det representeras genom att acceptera en proton från vattnet: vatten:
Rcn: + h2Eller ⇌ rcnh+ + Åh-
För att protonera RCN: elektronfritt vridmoment på kvävet måste bilda en länk med jon h+. Men det finns en besvär: Kvävehybridisering gör det för elektronegativt, så mycket att detta par av elektroner är mycket starkt lockad och tillåter inte ens en bindning att bilda.
Därför sägs det att kvävessperparet av kväve inte är tillgängligt och att basiciteten för nitriler är mycket låg. I själva verket är nitriler miljoner gånger mindre grundläggande än aminer.
Reaktivitet
Bland de mest representativa reaktionerna från nitriler har vi deras hydrolys och reduktion. Dessa hydrolyser medieras av surhet eller basicitet i den vattenhaltiga miljön, vilket orsakar en karboxylsyra respektive ett karboxylatsalt:
Kan tjäna dig: vätskevaporbalansRCN + 2H2O + HCl → RCOOH + NH4Kli
RCN + H2O + NaOH → RCONA + NH3
Under processen bildas också en amida.
Nitriler reduceras till aminer med väte- och metallkatalysatorer:
RCN → RCH2Nh2
Nomenklatur
Enligt IUPAC -nomenklaturen namnges nitrils genom att lägga till suffixet -nitrilen till namnet på alkankedjan från vilken den härstammar, inklusive cyanoens kol. Således Cho3CN kallas Ethanonitrilo och Cho3Ch2Ch2CN, butanonitril.
De kan också utses från namnet på karboxylsyra, som elimineras av ordet "syra", och suffixerna ersätts -oic eller -oico av suffixet -onitrilen. Till exempel för ch3CN skulle vara acetonitril (ättiksyra); För c6H5CN, det skulle vara bensonitril (av bensoesyra); Och för honom (Cho3)2CHCN, 2-metylpropanitril.
Alternativt, om namnen på alquiliciska substituenter beaktas, kan nitriler nämnas med ordet "cyanid". Till exempel Cho3CN skulle då kallas metylcyanid och (CHO3)2CHCN, isopropylcyanid.
Ansökningar
Nitriler är en del av naturliga produkter, som är i bittera mandlar, i benen hos olika frukter, i marina djur, växter och bakterier.
Dess CN -grupper utgör strukturerna för cyanogena lipider och glykosider, biomolekyler som när de nedbrutet frigör vätecyanid, HCN, en mycket giftig gas. Därför har de en överhängande biologisk användning för vissa varelser.
Det sades tidigare att CN -grupper ger mycket polaritet till molekylerna, och i själva verket går de inte obemärkt när de är närvarande i föreningar med farmakologisk aktivitet. Sådana nitrilmediciner har använts för att bekämpa hyperglykemi, bröstcancer, diabetes, psykos, depression och andra störningar.
Kan tjäna dig: irreversibel reaktion: egenskaper och exempelFörutom att ha en roll i biologi och medicin, utgör de industriellt en handfull nitrilplast, med vilken kirurgiska och laboratoriehandskar görs, frimärken av bildelar, slangar och leder på grund av deras motstånd mot korrosion och fetter, material som Material som Tupperware, musikinstrument eller Legos -block.
Nitrilexempel
Nästa och slutligen kommer några exempel på nitriler att listas.
Nitrilgummi
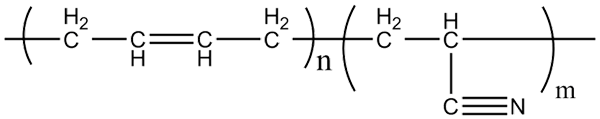 Molekylär struktur av akrilonitril-butadien-sampolymerer. Källa: Klever via Wikipedia.
Molekylär struktur av akrilonitril-butadien-sampolymerer. Källa: Klever via Wikipedia. Nitrilgummi, med vilket de ovannämnda handskarna och fettresistenta material tillverkas, är en sampolymer bildad av akilonitril och butadien (ovan). Observera hur linjär CN -gruppen ser ut.
Ciamemazin
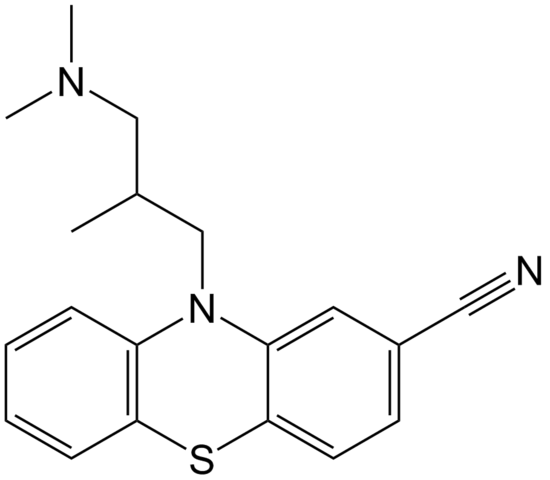 Molekylstruktur av cipemazin. Källa: EPOP / PUB -domän
Molekylstruktur av cipemazin. Källa: EPOP / PUB -domän Cyammazin är ett exempel på en nitril i apoteksområdet som används som antipsykotisk, särskilt för att behandla ångest och schizofrenisjukdomar. Notera igen lineariteten i CN -gruppen.
Citalopram
 Ett annat nitrilläkemedel är citalopram, används som ett antidepressiva medel
Ett annat nitrilläkemedel är citalopram, används som ett antidepressiva medel Amygdalin
 Molekylstrukturen i tonsilinet. Källa: Wesalius / allmän domän
Molekylstrukturen i tonsilinet. Källa: Wesalius / allmän domän Tonsilen är ett exempel på en cyanogen glukóside. Det finns i bittera mandlar, plommon, aprikoser och persikor. Notera hur liten CN -gruppen ser ut när det gäller resten av strukturen; Trots detta räcker dess enda närvaro för att ge en unik kemisk identitet till detta kolhydrat.
Referenser
- Graham solomons t.W., Craig b. Fryhle. (2011). Organisk kemi. (10th Utgåva.). Wiley Plus.
- Carey f. (2008). Organisk kemi. (Sjätte upplagan). MC Graw Hill.
- Morrison och Boyd. (1987). Organisk kemi. (Femte upplagan). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Nitril. Hämtad från: i.Wikipedia.org
- Kemi librettexts. (5 juni 2019). Nitrilkemi. Återhämtad från: kem.Librettexts.org
- Jim clark. (2016). Hydrolyserande nitriler. Återhämtat sig från: Chemguide.co.Storbritannien
- Ivy Rose Holistic. (2020). Nitrilamn. Hämtad från: ivyrose.com
- Germán Fernández. (s.F.). Nitril nomenklatur: IUPAC -regler. Återställt från: Chemicicicicaorganica.org
- « De 8 huvudsakliga psykologiska strömmarna och deras författare
- Metilaminstruktur, egenskaper, produktion, användningar »

