Bohr atommodell
- 4041
- 439
- Anders Larsson
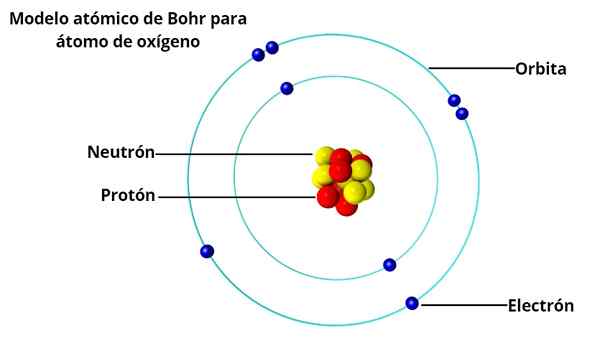
han Bohr atommodell Det är uppfattningen av den danska fysikern Niels Bohr (1885-1962) om atomens struktur, publicerad 1913. I Bohr -atomen ockuperar elektroner runt kärnan endast vissa tillåtna banor, tack vare en begränsning som heter kvantisering.
För Bohr, bilden av atomen som ett miniatyrsolsystem, med elektroner genom att kretsa runt kärnan, var den inte helt förenlig med det faktum att elektriska laddningar, när de accelereras, strålar energi.

En sådan atom skulle inte vara stabil, eftersom det skulle upphöra att kollapsa förr eller senare eftersom elektronerna skulle fälla ut spiralt till kärnan. Och då, för 50 år sedan de karakteristiska ljusmönstren som avger väte och andra gaser vid uppvärmning.
Mönstret eller spektrumet består av en serie ljusa linjer med vissa mycket specifika våglängder. Och väteatomen kollapsar inte genom att avge ljus.
För att förklara varför atomen är stabil trots att han kunde utstråla elektromagnetisk energi föreslog Bohr att vinkelmomentet bara kunde anta vissa värden, och därför energin också. Detta är vad som förstås genom kvantisering.
Electron accepterade att energin kvantiserades skulle elektronen ha den nödvändiga stabiliteten för att inte rusa mot kärnan som förstör atomen.
Och atomen utstrålar bara ljusenergi när elektronen gör övergångar från en bana till en annan, alltid i diskreta mängder. På detta sätt förklaras närvaron av utsläppsmönster i väte.
Bohr komponerade på detta sätt en vision av atomen som integrerar kända begrepp av klassisk mekanik med den nyligen upptäckta, såsom Plancks konstant, foton, elektron, atomkärnan (Rutherford hade varit en mentor för Bohr) och de ovannämnda spektra för problem.
[TOC]
BOHR -modellens huvudsakliga egenskaper
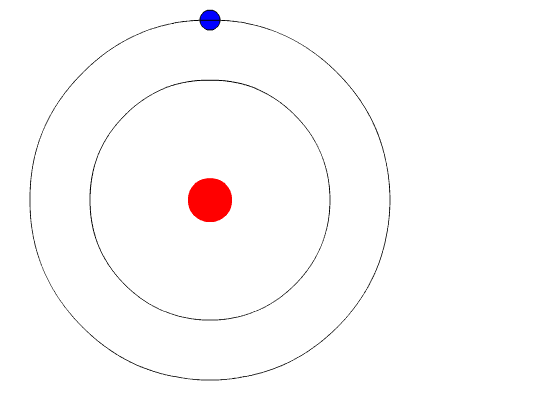 Bohr's Atom. Animeringen representerar elektronen när den går från en högre energinivå till en annan av mindre energi och avger ett ljus av ljus (en foton). Källa: Wikimedia Commons.
Bohr's Atom. Animeringen representerar elektronen när den går från en högre energinivå till en annan av mindre energi och avger ett ljus av ljus (en foton). Källa: Wikimedia Commons. Bohrs atommodell antar att elektronen rör sig i en cirkulär bana runt kärnan genom verkan av den elektrostatiska attraktionen av Coulomb och föreslår att elektronens vinkelmoment kvantiseras.
Kan tjäna dig: Balanseringsvektor: Beräkning, exempel, övningarLåt oss se hur man integrerar båda begreppen i matematisk form:
Låt l storleken på vinkelmomentet, m elektronens massa och elektronens hastighet och r radien för banan. För att beräkna L har vi:
L = m⋅r⋅v
Bohr föreslog att L var lika med hela multiplar av konstanten H/2π, där H är Planckkonstant, Introducerad för en kort tid sedan av fysikern Max Planck (1858-1947) för att lösa energiproblemet som släpps ut av en svart kropp, ett teoretiskt objekt som absorberar allt infallande ljus.
Dess värde är h = 6.626 × 10−34 J ・ S, medan det är på H/2π betecknas som ħ, Som läser "H Bar".
Därför kvarstår vinkelmomentet::
m⋅r⋅v = nħ, Med n = 1,2, 3 ..
Och från detta tillstånd dras radionerna för banorna tillåtna för elektronen, som vi kommer att se då.
Beräkning av elektronbanor radie
I det följande kommer vi att anta det enklaste av atomer: väte, som består av en enda proton och en elektron, både med en storleksbelastning och.
Den centripetala kraften som håller elektronen i sin cirkulära bana tillhandahålls av elektrostatisk attraktion, vars storlek är:
F = ke2/r2
Där k är den elektrostatiska konstanten för Coulomb och R-lagen elektron-proteinavståndet. Att veta att i en cirkulär rörelse centripetal accelerationc Det ges av anledning mellan kvadratet med hastighet och avstånd R:
tillc = v2 / r
Genom Newtons andra lag är nettokraften produkten av massa m genom acceleration:
Mv2/r = ke2/r2
Förenklande Radio R erhålls:
M⋅v2R = ke2
Genom att kombinera detta uttryck med det vinkelmoment har vi ett system med ekvationer, som ges av:
Det kan tjäna dig: Fysisk bana: Egenskaper, typer, exempel och övningar1) MV2R = ke2
2) r = n ħ/mv
Tanken är att lösa systemet och bestämma r, radien för den tillåtna bana. En liten elementär algebra leder till svaret:
R = (nħ)2 / K⋅m⋅e2
Med n = 1, 2, 3, 4, 5 ..
För n = 1 har vi minst av radioapparaterna, kallade Bohr Radio aantingen Med ett värde av 0,529 × 10−10 m. Radionerna för de andra banorna uttrycks i termer av tillantingen.
På detta sätt introducerar Bohr huvudnumret n, påpekar att de tillåtna radioapparaterna är baserade på Planck -konstanten, den elektrostatiska konstanten och massan och belastningen på elektronen.
Bohr Atomic Model postulates
 Dansk fysiker Niels Bohr (1885-1962).
Dansk fysiker Niels Bohr (1885-1962). Bohr kombinerar skickligt Newtonian mekanik med de nya upptäckterna som kontinuerligt hade gett under andra hälften av 1800 -talet och början av 1900 -talet. Bland dem det revolutionära begreppet "hur mycket", av vilket Planck själv påstod sig inte vara mycket övertygad.
Genom sin teori kunde Bohr tillfredsställande förklara serien för vätespektrumet och förutsäga energiutsläpp i rang som ultraviolett och infraröd, som ännu inte hade observerats.
Vi kan sammanfatta dina postulater enligt följande:
Elektroner beskriver cirkulära banor
Elektronen kretsar kring kärnan i stabil cirkulär bana, med enhetlig cirkulär rörelse. Rörelsen beror på den elektrostatiska attraktionen som kärnan utövar på den.
Vinkelmomentet är kvantiserat
Elektronens vinkelmoment kvantiseras enligt uttrycket:
L = mvr = nħ
Där n är ett heltal: n = 1, 2, 3, 4 ..., som leder till elektronen bara kan vara i vissa definierade banor, vars radioapparater är:
R = (n ħ)2 / k m e2
Elektroner avger eller absorberar fotoner när de flyttar från ett energitillstånd till ett annat
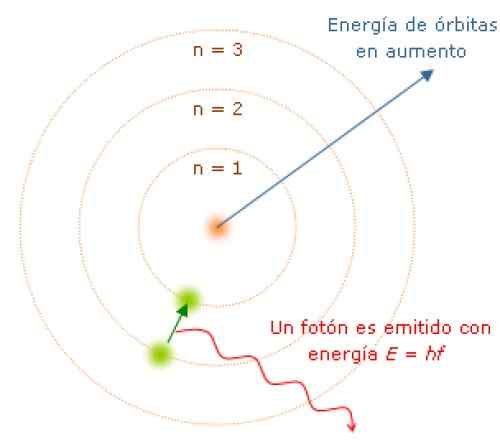
 När du flyttar från ett energitillstånd till ett annat absorberar eller avger elektronen energi i diskreta mängder som kallas fotoner. Källa: Wikimedia Commons.
När du flyttar från ett energitillstånd till ett annat absorberar eller avger elektronen energi i diskreta mängder som kallas fotoner. Källa: Wikimedia Commons. Eftersom vinkelmomentet är kvantiserat, energi och också. Det kan demonstreras att E ges av:
Kan tjäna dig: vertikalt skott: formler, ekvationer, exempel
Volt Electron eller EV, är en annan enhet för energi, som används allmänt i atomfysik. Den negativa tecknet i energi säkerställer bana stabilitet, vilket indikerar att arbetet bör göras för att skilja elektronen från denna position.
Medan elektronen befinner sig i sin bana inte absorberar eller avger ljus. Men när den hoppar från en bana med större energi till en lägre gör det.
Frekvensen f för det utsända ljuset beror på skillnaden mellan banornas energinivåer:
E = hf = eförsta - Eslutlig
Begränsningar
Bohr -modellen har vissa begränsningar:
-Det gäller bara framgångsrikt för väteatomen. Försök att applicera det på mer komplexa atomer fungerade inte.
-Det svarar inte varför vissa banor är stabila och andra inte. Det faktum att energin i atomen kvantiserades fungerade mycket bra, men modellen gav inte någon anledning, och det var något som orsakade obehag för forskare.
-En annan viktig begränsning är att den inte förklarade de ytterligare linjerna som utfärdats av atomer i närvaro av elektromagnetiska fält (Zeeman -effekt och stark effekt). Eller varför vissa spektrumlinjer var mer intensiva än andra.
-Bohr -modellen överväger inte relativistiska effekter, vilket är nödvändigt.
-Det tar för givet att det är möjligt att veta exakt elektronens position och hastighet, men det som verkligen beräknas är sannolikheten för att elektronen har en viss position.
Trots sina begränsningar hade modellen stor framgång vid den tiden, inte bara för att integrera nya upptäckter med redan kända element, utan eftersom den visade nya frågor, vilket gjorde det klart att vägen till en tillfredsställande förklaring av atomen var i kvantmekanik.
Intresseartiklar
Schrödinger Atomic Model.
Bros.
Chadwick atommodell.
Heisenberg atommodell.
Perrin atommodell.
Thomson Atomic Model.
Dalton Atomic Model.
Dirac Jordan Atomic Model.
Demokritusatommodell.
Leucipo Atomic Model.
Sommerfeld Atomic Model.
Nuvarande atommodell.


