Sommerfeld atommodellegenskaper, postulat, fördelar och nackdelar
- 2565
- 738
- Anders Larsson
han Sommerfeld Atomic Model Det skapades av den tyska fysikern Arnold Sommerfeld mellan 1915 och 1916 för att förklara de fakta som Bohr -modellen, som släpptes kort före 1913, kunde inte tillfredsställande förklara. Sommerfeld presenterade sina resultat först till Bayern Academy of Sciences och publicerade dem sedan i Annalen der Physik Magazine.
Atommodellen som föreslagits av den danska fysikern Niels Bohr beskriver.
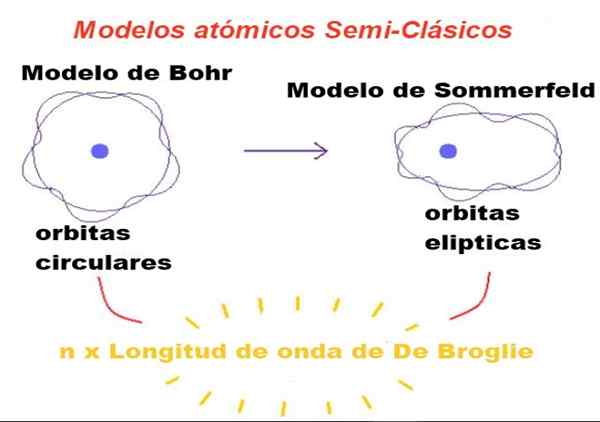
 Figur 1. I semi-klassiska modeller är banor Newtonian, men bara de vars omkrets är ett heltal antal gånger Broglie-våglängden är tillåtna. Källa: f. Zapata.
Figur 1. I semi-klassiska modeller är banor Newtonian, men bara de vars omkrets är ett heltal antal gånger Broglie-våglängden är tillåtna. Källa: f. Zapata. I teorin som föreslagits av Bohr kan elektronen som kretsar runt kärnan bara ha vissa värden på dess omloppsvinkelmoment, och därför kan den inte vara i någon bana.
Bohr ansåg också att dessa banor var cirkulära och ett enda kvantantal som heter huvudantal n = 1, 2, 3 ... tjänade till att identifiera de tillåtna banorna.
Den första modifieringen som introducerades av Sommerfeld till Bohr -modellen bestod av att anta att elektronbanan också kan vara elliptisk.
En omkrets beskrivs av dess radie, men för en ellips måste du ge två parametrar: semi -senije och mindre halv -Semi, utöver den rumsliga orienteringen av samma. Med detta introducerade han ytterligare två kvantnummer.
Den andra huvudmodifieringen som Sommerfeld gjorde var att lägga till relativistiska effekter till atommodellen. Det finns inget snabbare än ljuset, men Sommerfeld hade hittat elektroner med märkbart nära hastigheter, därför var det nödvändigt att införliva de relativistiska effekterna i någon beskrivning av atomen.
[TOC]
Postulat av Sommerfeld Atomic Model
Elektroner följer cirkulära och elliptiska banor
Elektroner i atomen följer elliptiska bana (cirkulära banor är ett särskilt fall) och deras energistatus kan karakteriseras av 3 kvantantal: det huvudsakliga kvantantalet n, Det sekundära kvantantalet eller det azimutala antalet l och det magnetiska kvantantalet mL.
Kan tjäna dig: binära salterTill skillnad från omkretsen har en ellips en större semije och en mindre hälft.
Men ellipser med samma stora semi -axel, de kan ha olika mindre halva -Semi, beroende på excentricitetsgraden. En excentricitet som är lika med 0 motsvarar en cirkel, så den utesluter inte cirkulära banor. Dessutom kan i rymden ellipser ha olika lutningar.
Det är därför Sommerfeld läggs till i sin modell det sekundära kvantantalet L för att indikera den mindre halvan och det magnetiska kvantantalet ML. Således påpekade han vad som är de tillåtna rumsliga orienteringarna för den elliptiska bana.
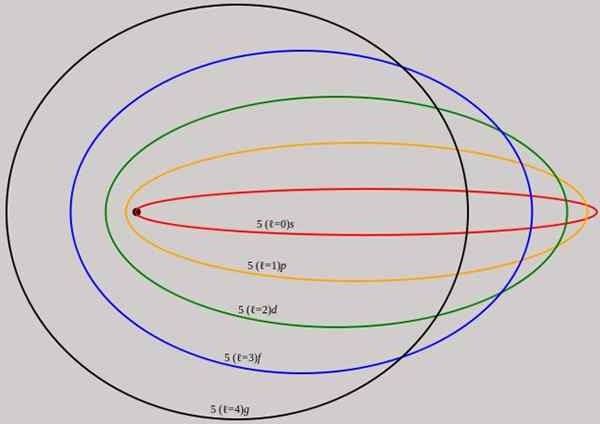 figur 2. De banor som motsvarar energinivån n = 5 visas för olika vinkelmoment l som har fullständiga våglängder för de Broglie. Källa: Wikimedia Commons.
figur 2. De banor som motsvarar energinivån n = 5 visas för olika vinkelmoment l som har fullständiga våglängder för de Broglie. Källa: Wikimedia Commons. Observera att den inte lägger till nya huvudkvantnummer, så elektronens totala energi i elliptisk bana är densamma som i Bohr -modellen. Därför finns det inga nya nivåer av energi, utan en utveckling av nivåerna som ges av nummer N.
Zeeman -effekt och stark effekt
På detta sätt är det möjligt att helt ange en given bana, tack vare de tre nämnda kvantenumren och därmed förklara förekomsten av två effekter: Zeeman -effekten och den starka effekten.
Och förklarar så utvecklingen av energi som förekommer i den normala Zeeman -effekten (det finns också en anomal zeemaneffekt), där en spektral linje är uppdelad i flera komponenter när den är i närvaro av ett magnetfält.
Denna utveckling av linjerna förekommer också i närvaro av ett elektriskt fält, som kallas Stark Effect, vilket fick Sommerfeld att tänka på modifieringen av Bohr -modellen för att förklara dessa effekter.
Atomarkärnan och elektronerna rör sig runt dess masscentrum
Efter att Ernest Rutherford upptäckte atomkärnan och att det faktum att nästan hela massan av atomen är koncentrerad där, trodde forskare att kärnan var mer eller mindre stationär.
Det kan tjäna dig: litiumhydroxid (LIOH)Sommerfeld antog emellertid att både kärnan och elektronerna i bana rör sig runt systemets masscentrum, vilket naturligtvis är mycket nära kärnan. Dess modell använder den reducerade massan för elektronkärnsystemet istället för elektronmassan.
I elliptiska banor, som med planeterna runt solen, finns det tillfällen då elektronen är närmare och i andra längre från kärnan. Därför är hastigheten annorlunda vid varje punkt i sin bana.
 Figur 3.- Arnold Sommerfeld. Källa: Wikimedia Commons. GFHUND [CC av 3.0 (https: // CreativeCommons.Org/licenser/av/3.0)].
Figur 3.- Arnold Sommerfeld. Källa: Wikimedia Commons. GFHUND [CC av 3.0 (https: // CreativeCommons.Org/licenser/av/3.0)]. Elektroner kan nå relativistiska hastigheter
Sommerfeld introducerade i sin modell konstanten av fin struktur, en konstant utan dimensioner relaterade till elektromagnetisk kraft:
α = 1/137.0359895
Det definieras som kvoten mellan elektronbelastningen och Jag kvadrat högt och produkten mellan Plancks konstant h och ljusets hastighet c I ett vakuum multiplicerat med 2π:
α = 2π (e2/h.c) = 1/137.0359895
Den fina strukturkonstanten berättar tre av de viktigaste konstanterna i atomfysiken. Den andra är elektronens massa, som inte visas här.
På detta sätt är det kopplat till elektronerna med fotonerna (som rör sig i hastighet C i tomrummet) och förklarar därmed avvikelserna från vissa spektrala linjer i väteatomen för förutsägelserna med Bohr -modellen.
Tack vare relativistiska korrigeringar, energinivåer med lika n Men annorlunda l De separerar, vilket ger upphov till den fina strukturstrukturen, därifrån namnet på konstanten a.
Och alla karakteristiska längder på atomen kan uttryckas i termer av denna konstant.
 Figur 4. Kvantiseringen av vinkelmoment L visas. Till skillnad från cirkulära banor, elliptiska. Källa: f. Zapata.
Figur 4. Kvantiseringen av vinkelmoment L visas. Till skillnad från cirkulära banor, elliptiska. Källa: f. Zapata. Fördelar och nackdelar
Fördelar
-Sommerfeld visade att ett enda kvantantal var otillräckligt för att förklara spektrallinjerna i väteatomen.
-Det var den första modellen som föreslog en rumslig kvantisering, eftersom prognoserna för banorna i riktning mot det elektromagnetiska fältet i själva verket är kvantiserade.
Kan tjäna dig: Plasmatillstånd: Egenskaper, typer och exempel-Sommerfeld -modellen förklarade tillfredsställande att elektroner med samma huvude kvantantal n skiljer sig åt i sitt energitillstånd, eftersom de kan ha olika kvantantal L och ML.
-Introducerade konstanten a för att utveckla den fina strukturen i atomspektrumet och förklara Zeeman -effekten.
-Det inkluderade de relativistiska effekterna, eftersom elektroner kan röra sig med hastigheter ganska nära ljuset.
Nackdelar
-Hans modell var endast tillämplig på atomer med en elektron och på många sätt till atomerna i alkaliska metaller som LI2+, Men det är inte användbart i heliumatomen, som har två elektroner.
-Förklarade inte den elektroniska fördelningen i atomen.
-Modellen fick beräkna energierna i de tillåtna staterna och frekvenserna för den strålning som utfärdats eller absorberas i övergångarna mellan stater, utan att ge information om tiderna för dessa övergångar.
-Nu är det känt att elektroner inte följer banor med förutbestämda former som banor, men att de upptar Orbitaler, Rymdregioner motsvarande Schrodinger -ekvationslösningar.
-Modellen godtyckligt kombinerade klassiska aspekter med kvantaspekter.
-Han misslyckades med att förklara anomal Zeeman -effekt, för detta behövs av DIRAC -modellen, som senare tilllade ytterligare ett kvantantal.
Intresseartiklar
Schrödinger Atomic Model.
Bros.
Chadwick atommodell.
Heisenberg atommodell.
Perrin atommodell.
Thomson Atomic Model.
Dalton Atomic Model.
Dirac Jordan Atomic Model.
Leucipo Atomic Model.
Bohr atommodell.
Nuvarande atommodell.
Referenser
- Hjärnkart. Sommerfeld Atom -modell och dess nackdelar. Återhämtat sig från: Brainkart.com.
- Hur vi lärde känna kosmos: Light & Matter. Sommerfeld's Atom. Hämtad från: Tastargarden.co.Storbritannien
- Parker, s. Bohr-sommerfeld atom. Återhämtat sig från: physnet.org
- Utbildningshörn. Sommerfeld. Återhämtad från: rinconucative.com.
- Wikipedia. Sommerfeld Atomic Model. Återhämtad från: är.Wikipedia, org.

