Korpuskulär materia
- 4071
- 538
- Johan Johansson
 De mest kända staterna i saken har sin förklaring i den korpuskulära modellen
De mest kända staterna i saken har sin förklaring i den korpuskulära modellen Vad är den korpuskulära modellen för materia?
han Korpuskulär materia Det är en modell av den mikroskopiska strukturen i materien, som försöker förklara egenskaperna och beteendet i varje aggregeringstillstånd.
Modellens grundläggande postulat är att materien består av små partiklar, som kan vara atomer, joner eller molekyler, alltid i kontinuerlig agitation.
I denna modell gäller lagarna i klassisk mekanik på partiklar, även om de av det närvarande stora antalet studeras inte individuellt utan genom en statistisk behandling. På detta sätt erhålls medelvärdena för de makroskopiska magnituden av intresse, såsom tryck, temperatur och volym.
Den korpuskulära modellen förklarar också egenskaper som viskositet, hårdhet, flexibilitet och densitet av material, liksom termisk dilatation, bland andra fenomen.
Ursprung till den korpuskulära materien
Idéerna om den korpuskulära naturen hos materiet är åtminstone det femte århundradet.C. I antika Grekland, Leucipo (450 a. C. - 370 a. C.) och Democritus (460 till 370 till c), lärjunge av det, hade spekulerat om organisationen av materia på mikroskopisk nivå.
Dessa filosofer föreslog att Matter består av små odelbara partiklar, utsedda atomer, Ett ord av grekisk rot som betyder exakt "odelbart".
Teorin utesluts av Aristoteles, den mest inflytelserika visningen i hans tid. Det var emellertid inte förrän det sjuttonde århundradet som korpuskulär teori började ta relevans igen, och på 1800 -talet började materiens hemligheter äntligen avslöja.
År 1803 föreslog den engelska kemisten John Dalton (1766-1844) att saken bildades av korpuskler som kallas atomer, som kombinerades i vissa proportioner för att bilda molekylerna i ett ämne.
Daltons atomer var odelbara, men snart utvecklades en solid teoretisk struktur, särskilt tack vare James C. Maxwell (1831-1979) och Ludwig Boltzmann (1844-1906). Detta etablerade grunden för statistisk mekanik och fysiken i det fasta tillståndet.
Det kan tjäna dig: medelhastighet: formler, hur det beräknas och lösesGrunderna i den korpuskulära materien
Modellens huvudpostulat är:
- Materi, oavsett deras status som aggregering, bildas av mikroskopiska partiklar, som kan vara individuella eller kombinerade atomer, för att bilda molekyler.
- De olika ämnena skiljer sig från varandra eftersom de utgörs av olika partiklar.
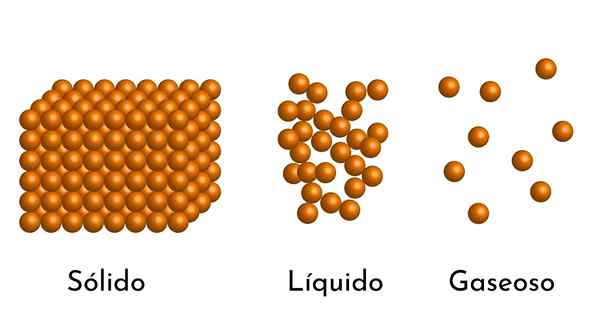
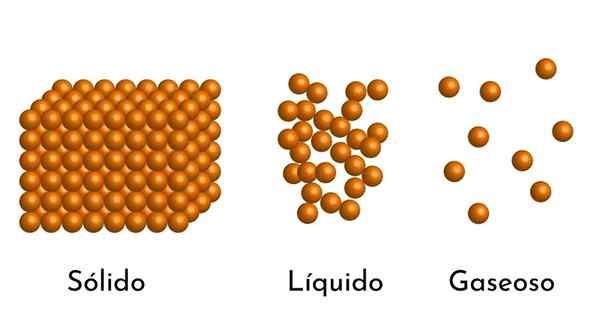
- Enligt tillståndet för aggregering av materia finns det tomma utrymmen mellan partiklarna, större i gaserna och mindre i fasta ämnen.
- De partiklar som utgör saken är i evig agitation. Till större omrörning, större kinetisk energi de har, och om värme tillsätts ökar partiklarnas rörelse.
- I vätskor och fasta ämnen upplever partiklarna också attraktion av olika intensiteter på grund av intermolekylära krafter. I gaser är molekylerna mycket separata och rör sig snabbt, så dessa krafter har ingen större incidens. Men i vätskor, vars partiklar har mer sammanhållning, är dessa krafter mer intensiva och i fasta ämnen är den ännu större.
Kinetisk teori om gaser
Den korpuskulära modellen applicerades först på gaser, eftersom det är det enklaste tillståndet för aggregering och sammanhållningskrafter mellan molekylerna är minimala. Dessutom var gasernas egenskaper välkända genom de experimentella verken av den engelska kemisten Robert Boyle och den franska Joseph Gay Lussac och Jacques Charles.
Den perfekta gasmodellen, den enklaste, överväger att:
- Storleken på partiklarna är mycket mindre än avståndet mellan dem, och att containernas dimensioner. De är specifika massor, det vill säga saknar dimensioner och upptar inte en volym.
- Partiklarna är i permanent agitation, är deras rörelse endast.
- Ibland kolliderar partiklarna elastiskt med varandra och med väggarna i containern. I helt elastiska chocker bevaras kinetisk energi.
- Det finns inga attraktiva krafter mellan molekyler. De enda interaktionerna beror på kollisioner som inträffar då och då och under en mycket kort tid. Av resten, varje molekyl verkar oavsett de andra.
- Om det inte finns några externa krafter som verkar på partikelsystemet, distribueras dessa enhetligt i hela den tillgängliga volymen.
Även om detta är den enklaste modellen, förklarar beteendet hos all tät gas vid höga temperaturer och låga tryck. Forskare har utvecklat andra bättre justerade modeller till beteendet hos verkliga gaser, för detta anser de att:
- Molekylerna har en mätbar storlek.
- Intermolekylära krafter avbryts inte.
Ideal gasekvation
Tack vare postulaten för den ideala gasen uppstår ett uttryck som relaterar de makroskopiska storleken på trycket P, volym V och temperatur T:
P ∙ v = nrt
Där n är antalet mol gas och r är den universella konstanten av gaser, vars värde i internationella systemenheter är 8.314 j/mol ∙ k.
Kinetisk energi och temperatur
I en idealisk gas manifesterar sig all inre energi som kinetisk energi. Den genomsnittliga kinetiska energin för N -molekylerna i en idealisk gas är direkt proportionell mot dess temperatur i Kelvin:
Korpuskulär modell i vätskor och fasta ämnen
Egentligen finns allt material i de tre enklaste tillstånden: som gas, vätska eller fast, beroende på tryck och temperatur. Det finns andra aggregeringstillstånd som plasma, men inte nära jordens yta.
Dessa stater beror på det sätt på vilket intermolekylära attraktionsstyrkor lagar, som är korta, det vill säga, de verkar inte om avståndet mellan molekyler är mycket stort och partiklarna rör sig vid hög hastighet. Detta är fallet med gaser, som tillåter fenomenet diffusion snabbare. Detta förklarar att genom att upptäcka aromen sprider sig aromen snabbt.
Kan tjäna dig: vad är det magnetiska ögonblicket?Å andra sidan, när partiklarna är närmare och deras rörelse är långsammare, som i vätskor och fasta ämnen, har dessa intermolekylära krafter möjlighet att utöva sin handling.
Således, när en gas passerar till vätsketillståndet, minskar volymen, eftersom avståndet mellan dess partiklar minskar och ännu mer när den blir solid.
Materia i flytande tillstånd
I flytande tillstånd är intermolekylära krafter inte föraktliga, men agerar i mindre skala än i fast tillstånd. Partiklarna bildar små grupper, som sönderdelas och omgrupperar kontinuerligt, vilket ger rörlighet till materialet, även om de upprätthåller en fast volym.
Denna rörlighet gör det möjligt för vätskor att anpassa sig till behållarens form och ger dem förmågan att flyta, förutom att de lättare kan blandas. Diffusionen kan inträffa, men långsammare än i gaser.
Trots detta har partiklarna tillräckligt med sammanhållning så att vätskan förblir inkomprimerbar i ett brett temperaturintervall.
Ytspänning
På ytan av vätskan finns molekyler på vilka obalanserade intermolekylära krafter verkar, vilket ger upphov till en nettokraft upp. Denna nettokraft minimeras när vätskan har den lägsta möjliga ytan.
Tack vare denna kraft, stift, klipp, insekter och andra små föremål lyckas stanna på vattenytan utan att sjunka.
 I den här bilden kan en molekyl ses på ytan av vätskan, på vilken en nettokraft verkar upp, vilket gör att insektet kan gå på vattnet utan att sjunka
I den här bilden kan en molekyl ses på ytan av vätskan, på vilken en nettokraft verkar upp, vilket gör att insektet kan gå på vattnet utan att sjunka Fast statlig fråga
I fast tillstånd är partiklarna mycket nära varandra, och de intermolekylära krafterna gör att partiklarna finns kvar i fasta positioner. Även om de kan vibrera runt denna position, antar fasta ämnen en definierad form och upprätthåller sin ständiga volym.
När värmen flyter ökar vibrationsrörelsens amplitud och temperaturen ökar. Detta får kroppsdimensionerna att öka med temperaturen, ett fenomen som kallas Termisk utvidgning. Om tillräckligt med värmeflöden kan det fasta till och med gå till vätskefasen.


