Dipolärt ögonblick hur det beräknas och exempel

- 2307
- 491
- Prof. Erik Johansson
han Dipolärt ögonblick Det är en kemisk egenskap som indikerar hur heterogent de elektriska laddningarna distribueras i en molekyl. Det uttrycks i Debye -enheter, 3,33 · 10-30 C · m, och vanligtvis varierar deras värden från 0 till 11 d.
Mycket polära föreningar tenderar att ha stora dipolmoment; Medan de apolära, små dipolmomenten. Ju mer polariserade elektriska laddningar är i en molekyl, desto större är dess dipolmoment; Det vill säga, det måste finnas en region rik på elektroner, Δ- och en annan dålig i elektroner, Δ+.
 De två färgutkastet fungerar som en analogi till två poler, positiva och negativa, av en molekyl med ett markant dipolmoment. Källa: Pexels.
De två färgutkastet fungerar som en analogi till två poler, positiva och negativa, av en molekyl med ett markant dipolmoment. Källa: Pexels. Dipolmomentet, μ, är en vektorstorlek, så det påverkas av länkarnas vinklar och i allmänhet av molekylstrukturen.
När molekylen är linjär kan den jämföras med ett tvåfärgat drag. Dess negativa slut Δ-, det skulle motsvara den röda färgen; Medan det positiva, Δ+, skulle vara den blå färgen. När storleken på negativa belastningar ökar i Δ-polen och avståndet som skiljer det från Δ+, ökar dipolmomentet.
Kemiskt innebär ovanstående att ju större skillnaden i elektronegativitet mellan två atomer och ju längre avståndet som skiljer dem, desto större dipolmoment mellan dem.
[TOC]
Hur beräknas dipolmomentet?
Det betraktas som en kovalent koppling mellan två atomer, A och B:
A-b
Avståndet mellan positiva och negativa partiella belastningar definieras redan av längden på länken:
TILLΔ+-BΔ-
Eftersom protoner och elektroner har samma storlek av elektrisk laddning men med motsatta tecken, 1.6 · 10-19C, detta är den som beaktas vid utvärdering av dipolmomentet mellan A och B genom följande ekvation:
Det kan tjäna dig: Skillnader mellan organiska och oorganiska föreningarμ = Δ ·d
Där μ är dipolmomentet är Δ elektronbelastningen utan det negativa tecknet, och d Länken på länken uttryckt i meter. Till exempel förutsatt det d Den har ett värde på 2 Å (1 · 10-10m) Dipolmomentet, μA-B kommer att vara:
μA-B = (1.6 · 10-19C) · (2 · 10-10m)
= 3,2 · 10-29Centimeter
Men eftersom detta värde är mycket litet används Deby -enheten:
μ = (3,2 · 10-29C · m) · (1 d/3,33 · 10-30 Centimeter)
= 9,60 d
Detta μA-B-värde kan anta att A-B-länken är mer jonisk än kovalent.
Exempel
Vatten
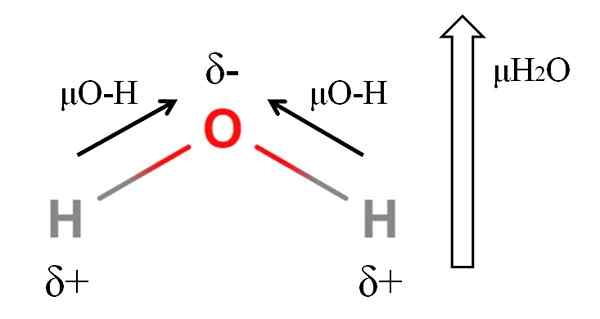 Dipoar Moment of a Water Molecule. Källa: Gabriel Bolívar.
Dipoar Moment of a Water Molecule. Källa: Gabriel Bolívar. För att beräkna dipolmomentet för en molekyl måste du lägga till alla dipolmoment i deras respektive länkar, med tanke på vinklarna på länkar och lite trigonometri. Detta först.
Vatten har ett av de största dipolmomenten som kan förväntas för en kovalent förening. I den övre bilden har vi att väteatomer har positiva partiella belastningar, 5+, medan syre bär den negativa partiella belastningen, 5-. O-H-länken är ganska polär (1.5d), och det finns två av dem i en H -molekyl2ANTINGEN.
I allmänhet dras en vektor från den mindre elektronegativa atomen (H) till den mest elektronegativa (O). Även om de inte ritas, finns det på syreatomen två par inte delade elektroner, som "koncentrerar" den negativa regionen ännu mer mer.
På grund av vinkelgeometri för H2Eller dipolmomenten går i riktning mot syreatomen. Observera att summan av de två μO-H skulle ge 3D (1.5+1.5); Men det är inte så. Dipolmomentet för vatten har ett experimentellt värde på 1.85d. Här är effekten av den nära vinkeln på 105º mellan H-O-H-länkarna.
Det kan tjäna dig: Laboratorietermometer: Egenskaper, vad är det för, användning, exempelMetanol
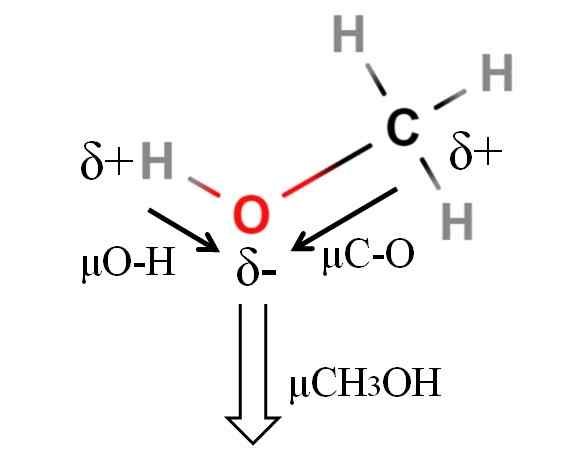 Dipoar Moment of a Methanol Molecule. Källa: Gabriel Bolívar.
Dipoar Moment of a Methanol Molecule. Källa: Gabriel Bolívar. Metanolens dipolmoment är 1.69d. Är mindre än vatten. Därför har atommassor inte alltför stort inflytande vid dipolmomentet; Men hans atomradio. När det gäller metanol kan vi inte bekräfta att din H-O-länk har en μ lika med 1.5 d; Sedan är molekylära miljöer olika i Cho3Åh och h2ANTINGEN.
Det är därför vi måste mäta längden på H-O-länken i metanolen för att kunna beräkna μO-H. Vad som kan bekräftas är att μO-H är större än μC-O.
Metanol katalogiseras som en av de mest polära lösningsmedlen som kan hittas tillsammans med vatten och ammoniak.
Ammoniak
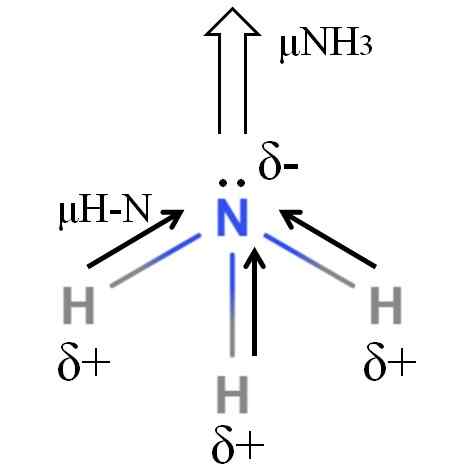 Dipoar -ögonblick av en ammoniakmolekyl. Källa: Gabriel Bolívar.
Dipoar -ögonblick av en ammoniakmolekyl. Källa: Gabriel Bolívar. H-N-bindningar är ganska polära, så kväve efter dess större elektronegativitet lockar elektroner mot sig själv (överlägsen bild). Utöver detta har vi på honom ett par opakterade elektroner, som bidrar med deras negativa belastningar till 5 -regionen-. Därför dominerar elektriska laddningar i ammoniakkväveatomen.
Ammoniaken har ett dipolmoment på 1.42d, mindre än metanol. Om både ammoniak och metanol kunde omvandlas till utkast, skulle man se att utkastet till metanolen har mer definierade poler jämfört med ammoniakens utkast.
Etanol
När det gäller etanol3Ch2Åh ditt dipolmoment är mycket nära metanolens, men det tenderar att ha lägre värden. Med mer kolatomer som komponerar 5+-regionen börjar syreatomen som representerar 5- och förlorar lite av sin "relativa negativa intensitet".
Kan tjäna dig: dimetylamin ((CH3) 2NH): struktur, egenskaper, användningar, riskerKoldioxid
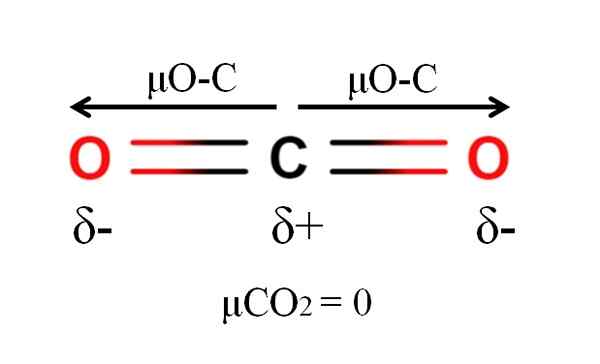 Dipoar -ögonblick av en koldioxidmolekyl. Källa: Gabriel Bolívar.
Dipoar -ögonblick av en koldioxidmolekyl. Källa: Gabriel Bolívar. Koldioxid har två polära bindningar, C = O, med sina respektive dipolmoment μO-C. Men som framgår av den överlägsna bilden, den linjära geometrien för CO2 Gör de två μO-C vektoriellt avbryta varandra, även om kolet har en positiv partiell belastning och syre negativa partiella belastningar.
Av denna anledning är koldioxid en apolär molekyl, eftersom μco2 har ett värde på 0D.
Metan
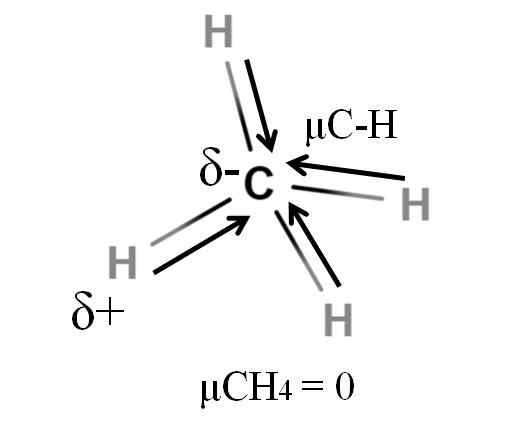 Dipolärt ögonblick för en metanmolekyl. Källa: Gabriel Bolívar.
Dipolärt ögonblick för en metanmolekyl. Källa: Gabriel Bolívar. Både metan och koldioxid delar något gemensamt: de är mycket symmetriska molekyler. I allmänhet, ju mer symmetrisk en molekyl, desto mindre kommer dess dipolmoment att vara.
Om vi ser molekylen i Cho4, Dess C-H-bindningar är polära och elektronerna riktas mot kolatomen eftersom de är lite mer elektronegativa. Man kunde tro att kol måste vara en mycket negativ 5 -region; som ett utkast med dess intensiva röda centrum och dess blåaktiga ändar.
Men när Cho är uppdelat4 I hälften skulle vi få två H-C-H-halvor, en till vänster och den andra till höger, liknande molekylen H2ANTINGEN. Således avbryts dipolmomentet som härrör från att lägga till dessa två μC-H med den för den andra hälften. Och därför μCh4 har ett värde på 0D.
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan.). Cengage Learning.
- Walter J. Moore. (1963). Fysisk kemi. I kemisk kinetik. Fjärde upplagan, Longmans.
- Iran. Levin. (2009). Principer för fysikalik. Sjätte upplagan, sidan 479-540. MC Graw Hill.
- Helmestine, Anne Marie, PH.D. (29 januari 2020). Dipolmomentdefinition. Återhämtat sig från: tankco.com
- Blaber mike. (29 september 2019). Dipolmoment. Kemi librettexts. Återhämtad från: kem.Librettexts.org
- Larita Williams. (2020). Dipolmoment: Definition, ekvation och exempel. Studie. Återhämtat sig från: studie.com
- Wikipedia. (2020). Bond dipolmoment. Hämtad från: i.Wikipedia.org
- « Gasbelysning hur man upptäcker det och 5 tips för att undvika det
- Onomatopoeia -egenskaper, funktion, typer, exempel »

