Redox Balance Method Steps, Exempel, övningar
- 2216
- 598
- Erik Eriksson
han Redoxbalanseringsmetod Det är en som gör det möjligt att balansera de kemiska ekvationerna för redoxreaktioner, som annars skulle vara en huvudvärk. Här utbyter en eller flera arter elektroner; Den som donerar eller förlorar dem kallas oxidantarter, medan den som accepterar eller vinner dem, en reduktiv art.
I denna metod är det viktigt att känna till oxidationsnumren för dessa arter, eftersom de avslöjar hur många elektroner som har fått eller förlorat med mol. Tack vare detta är det möjligt att balansera de elektriska laddningarna genom att skriva i ekvationerna elektronerna som om de var reaktanter eller produkter.
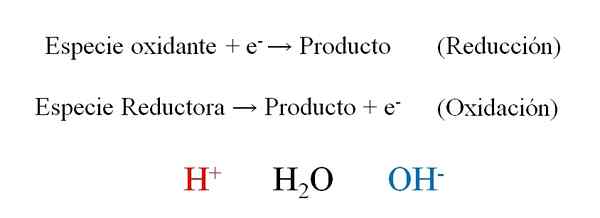
 Allmänna semi -återlämningar av en redoxreaktion med de tre huvudpersonerna under deras balansering: H+, H2O och OH-. Källa: Gabriel Bolívar.
Allmänna semi -återlämningar av en redoxreaktion med de tre huvudpersonerna under deras balansering: H+, H2O och OH-. Källa: Gabriel Bolívar. Den överlägsna bilden visar hur elektroner effektivt och- De placeras som reagens när den oxiderande arten vinner dem; Och som produkter när den reducerande arten förlorar dem. Observera att för att balansera denna typ av ekvationer är det nödvändigt att behärska begreppen oxidation och oxidationsnummer.
Arten h+, H2Eller och åh-, Beroende på pH för reaktionsmediet tillåter det redoxbalansering, så det är mycket vanligt att hitta dem i övningarna. Om mediet är syra vänder vi oss till h+; Men om vi tvärtom är grundläggande, använder vi OH- För balansering.
Själva reaktionen dikterar vad värdet för mediet ska vara. Det är därför, även om det kan balanseras genom att anta ett syra eller basmedium, kommer den slutliga balanserade ekvationen att indikera om jonerna h är osannolika eller inte riktigt+ och åh-.
[TOC]
Steg
- Allmän
Kontrollera oxidationsnumren för reagens och produkter
Anta att följande kemisk ekvation:
Cu (s) + agno3(AC) → CU (nej3)2 + Ag (s)
Detta motsvarar en redoxreaktion, där en förändring i reagensens oxidationsnummer inträffar:
Cu0(S) + Ag+NEJ3(AC) → CU2+(NEJ3)2 + Ag (s)0
Identifiera oxiderande och reduktiva arter
De oxiderande arterna får elektroner som oxiderar den reducerande arten. Därför minskar dess oxidationsnummer: det blir mindre positivt. Samtidigt ökar oxidationsnumret för de reducerande arterna, eftersom det förlorar elektroner: det blir mer positivt.
I den tidigare reaktionen oxideras således koppar, eftersom den går från CU0 till cu2+; Och silver reduceras, eftersom det går från Ag+ En ag0. Koppar är den reducerande arten och silver den oxiderande arten.
Skriv semi -reaktioner och balansatomer och belastningar
Identifiering av vilka arter som får eller förlorar elektroner, redox halvreaktioner skrivs för både reduktionsreaktionen och oxidationen:
Cu0 → CU2+
Ag+ → Ag0
Koppar förlorar två elektroner, medan silver vinner en. Vi placerar elektronerna i båda semi -reaktionerna:
Kan tjäna dig: kaliumfosfat (K3PO4): Struktur, egenskaper, användningarCu0 → CU2+ + 2e-
Ag+ + och- → Ag0
Observera att belastningarna förblir balanserade i båda semi -reaktionerna; Men om de tillkom, skulle lagen om bevarande av materia kränkas: antalet elektroner måste vara detsamma i de två semi -reaktionerna. Därför multipliceras den andra ekvationen med 2 och de två ekvationerna läggs till:
(CU0 → CU2+ + 2e-) x 1
(Ag+ + och- → Ag0) x 2
Cu0 + 2ag+ + 2e- → CU2+ + 2ag0 + 2e-
Elektronerna avbryts för att vara på sidorna på reagens och produkter:
Cu0 + 2ag+ → CU2+ + 2ag0
Detta är den globala joniska ekvationen.
Byt ut koefficienter för den joniska ekvationen i den allmänna ekvationen
Slutligen flyttar de stökiometriska koefficienterna för den tidigare ekvationen till den första ekvationen:
CU (S) + 2AGNO3(AC) → CU (nej3)2 + 2ag (s)
Observera att de två var placerade med Agno3 För i detta salt är silveret som Ag+, Och detsamma gäller CU (nej3)2. Om denna ekvation inte är balanserad i slutet görs poängen.
Ekvationen som föreslogs i de föregående stegen kunde ha balanserats direkt av Tanteo. Det finns emellertid redoxreaktioner som behöver ett surt medium (h+) eller grundläggande (OH-) att ta plats. När detta händer kan det inte vara balanserat förutsatt att mediet är neutralt; som det just har visat (det lades inte till eller h+ Och antingen oh-).
Å andra sidan är det bekvämt att veta att de semi -reaktionerna skrivna atomer, joner eller föreningar (mestadels oxider) där förändringar i oxidationsnummer inträffar. Detta kommer att markeras i avsnittet Övningar.
- Balansera i surt medium
När mediet är syra måste du stanna vid de två semi -reaktionerna. Denna gång vid tidpunkten för balansen ignorerar vi syre- och väteatomerna, och även elektroner. Elektroner kommer att balansera i slutet.
Sedan, på reaktionssidan med mindre syreatomer, lägger vi till vattenmolekyler för att kompensera för det. På andra sidan balanserar vi hydrogener med hjoner+. Och slutligen lägger vi till elektronerna och fortsätter efter de allmänna stegen som redan exponerats.
- Balansera i grundläggande medium
När mediet är grundläggande är det på samma sätt som i den sura miljön med en liten skillnad: den här gången på sidan där det finns mer syre kommer en vattenmolekyler som är lika med detta överskott av syre lokaliserade; Och på andra sidan, ohjoner- Att kompensera för hydrogener.
Slutligen tillsätts elektronbalans, de två semi -reaktionerna, och koefficienterna för den globala jonekvationen i den allmänna ekvationen ersätts.
Kan tjäna dig: spridda system: typer, egenskaper och exempelExempel
Följande redoxekvationer utan balans och balanserad fungerar som exempel för att observera hur mycket förändring efter tillämpning av denna balansmetod:
P4 + Klo- → PO43- + Kli- (utan balans)
P4 + 10 CLO- + 6 h2O → 4 PO43- + 10 cl- + 12 h+ (Balanserad halvsyra)
P4 + 10 CLO- + 12 åh- → 4 PO43- + 10 cl- + 6 h2O (grundläggande medelbalanserad)
Yo2 + Kno3 → i- + Kio3 + NEJ3- (utan balans)
3i2 + Kno3 + 3 timmar2O → 5i- + Kio3 + NEJ3- + 6h+ (Balanserad halvsyra)
Cr2ANTINGEN27- + Hno2 → Cr3+ + NEJ3- (utan balans)
3hno2 + 5 timmar+ + Cr2ANTINGEN27- → 3no3- +2cr3+ + 4 timmar2O (balanserad syrbalans)
Övningar
Övning 1
Balansera följande ekvation i basmedium:
Yo2 + Kno3 → i- + Kio3 + NEJ3-
Allmänna steg
Vi börjar med att skriva oxidationsnumren för de arter som vi misstänker har rostiga eller minskade; I detta fall jodatomer:
Yo20 + Kno3 → i- + Ki5+ANTINGEN3 + NEJ3-
Observera att jod oxiderar och samtidigt reduceras, så vi fortsätter med att skriva dess två respektive halvreaktioner:
Yo2 → i- (Minskning, för varje i- 1 elektron konsumeras)
Yo2 → io3- (Oxidation, för varje IO3- 5 elektroner släpps)
I oxidation av halvljus placerar vi anjonen io3-, och inte till Atom av jod som jag5+. Vi balanserar jodatomerna:
Yo2 → 2i-
Yo2 → 23-
Balansera i grundläggande medium
Nu fokuserar vi på att svänga i basmedium semi -reaktionen av oxidation, eftersom det har en syresatt art. Vi lägger till sidan av produkterna samma antal vattenmolekyler såsom syreatomer:
Yo2 → 23- + 6h2ANTINGEN
Och på vänster sida balanserar vi hydrogener med OH-:
Yo2 + 12OH- → 23- + 6h2ANTINGEN
Vi skriver de två semi -reaktionerna och lägger till de saknade elektronerna för att balansera de negativa belastningarna:
Yo2 + 2e- → 2i-
Yo2 + 12OH- → 23- + 6h2O + 10e-
Vi matchade båda elektronerna i båda semi -reaktionerna och lägger till dem:
(Yo2 + 2e- → 2i-) x 10
(Yo2 + 12OH- → 23- + 6h2O + 10e-) x 2
12i2 + 24 åh- + 20e- → 20i- + 4th3- + 12 timmar2O + 20e-
Elektronerna avbryts och delas upp alla koefficienter med fyra för att förenkla den globala jonekvationen:
(12i2 + 24 åh- → 20i- + 4th3- + 12 timmar2O) x ¼
3i2 + 6OH- → 5i- + Io3- + 3 timmar2ANTINGEN
Och slutligen ersätter vi koefficienterna för den joniska ekvationen i den första ekvationen:
3i2 + 6OH- + Kno3 → 5i- + Kio3 + NEJ3- + 3 timmar2ANTINGEN
Det kan tjäna dig: jonisk kraft: enheter, hur man beräknar det, exempelEkvationen är redan balanserad. Jämför detta resultat med balanseringen i ett syramedium i exempel 2.
Övning 2
Balansera följande ekvation i surt medium:
Tro2ANTINGEN3 + CO → FE + CO2
Allmänna steg
Vi observerar oxidationsnumren av järn och kol att veta vilken av de två som har oxiderat eller minskat:
Tro23+ANTINGEN3 + C2+O → Tro0 + C4+ANTINGEN2
Järn har minskat, så det är den oxiderande arten. Samtidigt har kol rostigt och uppför sig som den reducerande arten. Semi -reaktionerna för oxidation och omarbetning avseende är:
Tro23+ANTINGEN3 → Tro0 (Reduktion, för varje tro 3 elektroner konsumeras)
CO → CO2 (Oxidation, för varje CO2 2 elektroner släpps)
Observera att vi skriver oxiden, tron2ANTINGEN3, Eftersom det innehåller tro3+, Istället för att bara placera tro3+. Vi balanserar atomerna som behövs utom syre:
Tro2ANTINGEN3 → 2Fe
CO → CO2
Och balanseringen utförs i syran i båda halvreaktioner, eftersom det finns syresatta arter däremellan.
Balansera i surt medium
Vi lägger till vatten för att balansera syre och sedan h+ För att balansera hydrogener:
Tro2ANTINGEN3 → 2Fe + 3H2ANTINGEN
6h+ + Tro2ANTINGEN3 → 2Fe + 3H2ANTINGEN
Co + h2O → CO2
Co + h2O → CO2 + 2h+
Nu balanserar vi belastningarna genom att placera de elektroner som är involverade i semi -reaktionerna:
6h+ + 6e- + Tro2ANTINGEN3 → 2Fe + 3H2ANTINGEN
Co + h2O → CO2 + 2h+ + 2e-
Vi matchar antalet elektroner i båda halvreaktioner och lägger till dem:
(6h+ + 6e- + Tro2ANTINGEN3 → 2Fe + 3H2O) x 2
(CO + H2O → CO2 + 2h+ + 2e-) x 6
12 h+ + 12e- + 2Fe2ANTINGEN3 + 6co + 6h2O → 4FE + 6H2O + 6co2 + 12 timmar+ + 12e-
Vi avbryter elektroner, hjoner+ Och vattenmolekylerna:
2Fe2ANTINGEN3 + 6co → 4fe +6co2
Men dessa koefficienter kan delas upp med två för att förenkla ekvationen ännu mer, att ha:
Tro2ANTINGEN3 + 3CO → 2FE +3CO2
Denna fråga uppstår: redoxbalansering för denna ekvation var nödvändig? Av Tanteo skulle det ha varit mycket snabbare. Detta visar att denna reaktion fortskrider omväxlande från medium pH.
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan.). Cengage Learning.
- Helmestine, Anne Marie, PH.D. (22 september 2019). Hur man balanserar redoxreaktioner. Återhämtat sig från: tankco.com
- Ann Nguyen & Luvleen Brar. (5 juni 2019). Redoxreaktioner balanserar. Kemi librettexts. Återhämtad från: kem.Librettexts.org
- Quimitube. (2012). ÖVNING 19: Justering av en redoxreaktion i basmedium med två oxidationssemeaktioner. Återhämtat sig från: Quimitube.com
- Washington University i ST. Louis. (s.F.). Öva problem: redoxreaktioner. Återhämtat sig från: kemi.Wustl.Edu
- John Wiley & Sons. (2020). Hur man balanserar redoxekvationer. Återhämtat sig från: dummies.com
- Rubén Darío eller. G. (2015). Balansering av kemiska ekvationer. Återställt från: Lär dig i Linea.du.Edu.co
- « Ojämlikhet och sociala rörelser i Mexiko (1950-1980)
- Mohr Method Fundamentals, Reaktioner, procedur, användningar »

