Bariumnitratkemisk struktur, användningar, egenskaper

- 3538
- 853
- Johan Johansson
han bariumnitrat Det är ett salt som består av en bariumatom (BA) och nitratjon (nej3). Det presenteras som ett vitt kristallint fast vid rumstemperatur och finns i naturen som ett mycket sällsynt mineral som kallas Nitrobarita. Dess egenskaper gör det till en giftig förening som måste hanteras noggrant.
I själva verket har denna förening flera användningsområden i den militära industrin, eftersom den kan kopplas till andra kemiska ämnen och läggas till explosiva och inklippande formuleringar, bland andra.
 Bariumnitratutseende. Källa: W. Oelen/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/3.0)
Bariumnitratutseende. Källa: W. Oelen/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/3.0) [TOC]
Formel
Bariumnitrat, även kallad bariumdyitrat, har den kemiska formeln BA (nej3)2, och tillverkas vanligtvis genom två metoder.
Den första av dessa involverar upplösning av små bitar av bariumkarbonat (Bacchus3) I ett medium -acidiskt medium (HNO3, en mycket frätande mineralsyra), vilket gör att järnföroreningar fälls ut och sedan filtreras, indunstas och kristalliseras denna blandning.
Den andra metoden görs genom kombinationen av bariumklorid (BACL2, En av bariumsalterna av större löslighet i vattnet) med en förvärmd lösning av natriumnitrat. Detta genererar en reaktion som resulterar i separationen av blandningsbariumnitratkristaller.
Kemisk struktur av bariumnitrat
Detta salt presenterar egenskaper hos kubisk kristallin struktur eller vattenfria octaedros.
Dess kemiska struktur är som följer:
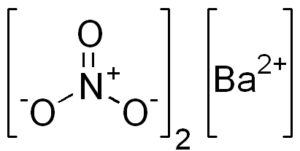
Dissociation
Vid höga temperaturer (592 ºC) sönderdelas bariumnitrat för att bilda bariumoxid (BAO), kvävedioxid (NO2) och syre (eller2), Enligt följande kemiska reaktion:
Kan tjäna dig: berylhydroxid (vara (OH) 2)2BA (nej3)2 + Värme → 2bao + 4no2 +ANTINGEN2
I media med höga koncentrationer av kväveoxid (NO) producerar nedbrytningen av bariumnitrat en förening som kallas bariumnitrit (BA (NO2)2), Enligt följande ekvation:
Badrum3)2 + 2no → BA (nej2)2 + 22
Reaktioner med löslig metall eller svavelsyrsulfater (h2Sw4) generera bariumsulfat (BASO4). Den stora majoriteten av olösliga bariumsalter, såsom karbonat (Bacchus3), Oxalat (BAC2ANTINGEN4) eller metallfosfat (BA3(PO4)2), fälls ut genom liknande dubbla nedbrytningsreaktioner.
Bariumnitratanvändning
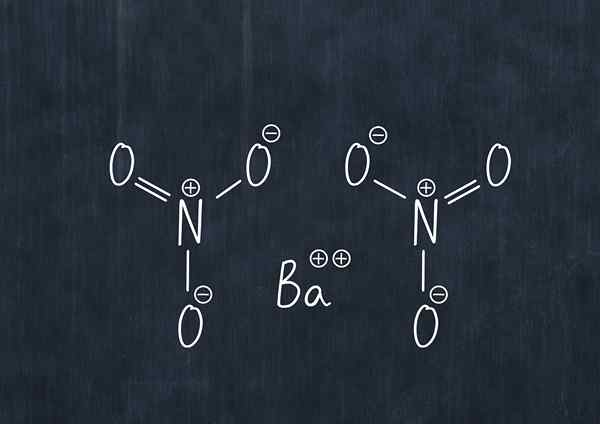 Kemisk formel av bariumnitrat
Kemisk formel av bariumnitrat Detta ämne i damm är ett oxiderande medel och reagerar avsevärt med vanliga reducerande medel.
När detta salt blandas med andra metaller, såsom aluminium eller zink i dess fint uppdelade former, eller med legeringar såsom aluminiummagn0esio, slår det på och utnyttjar påverkan. Av denna anledning betraktas bariumnitrat som en utmärkt del av militära vapen och sprängämnen.
Tillsammans med trinitrotoluen (kommersiellt känd som TNT, eller C6H2(NEJ2)3Ch3) och ett bindemedel (regelbundet paraffinvax), detta salt bildar en förening som kallas baratol, som har explosiva egenskaper. Den höga tätheten av bariumnitrat gör att baratolen också får en större densitet, vilket gör den mer effektiv i sin funktion.
Bariumnitrat går också med i aluminiumdamm, en formel som resulterar i bildandet av blinkande krutt, som huvudsakligen används i fyrverkerier och teaterpyroteknik.
Detta blinkar har också sett användningar vid produktion av blossar (såsom antimilmått på flygplan) och i bedövade granater. Dessutom är detta ämne mycket explosivt.
Det kan tjäna dig: natriumcyanid (NACN): struktur, egenskaper, risker, användningarDetta salt kombineras med den reaktantblandningen som kallas termit för att bilda en variation av detta så kallade termat, som genererar korta och mycket kraftfulla blinkningar av höga temperaturer i små områden under en kort tid.
Termat-th3 är en termat som innehåller en 29 % sammansättning med bariumnitratvikt, vilket hjälper till att öka den termiska effekten, generera lågor och avsevärt minska termatets temperatur på termen.
Theroots används vanligtvis vid produktion av brinnande granater och har funktionen att förstöra militär tankpansar och strukturer.
Dessutom var bariumnitrat en av de mest använda ingredienserna i produktionen av brännande avgifter som användes av briterna i deras krigsflygplan under andra världskriget, som beväpnade med brännande ammunition som tjänade till att förstöra fiendens flygplan.
Slutligen har detta salt använt i tillverkningsprocessen för bariumoxid, inom den termiska ventilindustrin och, som redan sagt, i skapandet av pyroteknik, särskilt de i gröna färger.
Fysiska och kemiska egenskaper
 Bario Bai Nitrato (No3) 2
Bario Bai Nitrato (No3) 2 Salt presenteras som ett vitt, hygroskopiskt och toalettfast, vilket är lite lösligt i vatten och helt olösligt i alkoholer.
Den har en molmassa på 261 337 g/mol, en densitet på 3,24 g/cm3 och en fusionspunkt på 592 ºC. När den når sin kokpunkt bryts den ner, som har sagts ovan. Vid rumstemperatur har den vattenlöslighet på 10,5 g/100 ml.
Det anses vara stabilt, men det är ett starkt oxidationsmedel och måste vara borta från brännbara material för att undvika eld. Den har vattenkänslighet och bör inte blandas med syror eller vattenfri.
Kan tjäna dig: adsorptionsisotermer: koncept, typer, exempelI höga koncentrationer (till exempel behållare) måste isoleras från ämnen som kan göra att den reagerar, eftersom det kan utnyttja våldsamt.
Som alla andra lösliga föreningar av barium är det ett giftigt ämne för djur och människor.
Det bör inte inhaleras eller konsumeras, eftersom symtom på förgiftning (särskilt härdning av ansiktsmuskler), kräkningar, diarré, buksmärta, muskelskakningar, ångest, svaghet, andningsbesvär, hjärt oregelbundenhet och anfall och anfall och anfall.
Döden kan inträffa efter en förgiftning med detta ämne, några timmar eller några dagar efter presentation.
Inandning av bariumnitrat genererar irritation i andningsslemhinnan och i båda förgiftningssätten måste lösningar av sulfatsalter vara beredda att applicera första hjälpen till de drabbade.
Vid spill måste det isoleras från brännbara ämnen och material och i fall av eld bör du aldrig komma i kontakt med torra kemikalier eller skum. Området måste översvämmas med vatten om elden är större.
Referenser
- Mabus. (s.F.). Sciencemadness. Erhållet från Sciencemadness.org
- USA: s inceniära bomb Th3-M50A3. (s.F.). Erhållet från ammunitionsbilder.com
- Comeo kemikalier. (s.F.). Erhållet från komokemikalier.Noaa.Gov
- Tanka. (s.F.). Erhållet från Chemspider.com

