Kaliumnitrit (KNO2) struktur, egenskaper och användningar

- 1748
- 376
- PhD. Lennart Johansson
han Kaliumnitrit Det är ett oorganiskt salt vars kemiska formel är som2, som är kemiskt och farmakologiskt relaterat till kaliumnitrat3. Hans fysiska utseende består av gulaktiga vita kristaller, mycket hygroskopiska, och därför delikéer; det vill säga de upplöses snabbt i fuktiga miljöer.
Dess formel indikerar att andelen kjoner+ och inte2- Det är 1: 1 och förblir förenad av elektrostatiska krafter eller av joniska länkar. Rena naturliga källor har tydligen inte hittat för sina kristaller, även om niter -anjoner kan hittas i jord, gödselmedel, växter och djur.
 Kaliumkristaller. Källa: Leiem [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]
Kaliumkristaller. Källa: Leiem [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] Den övre bilden visar hur Knos kristaller ser ut2, Med uttalade gula toner. Om dessa kristaller lämnas i kontakt med luften kommer de att absorbera fukt för att bli en vattenlösning; lösning som har genererat kontroverser med avseende på huruvida dess användning är till nytta eller inte.
Å andra sidan används dess kristaller, under mycket små mängder (200 ppm) för att salta kött och garantera deras bevarande mot bakteriell verkan. Också Kno2 Förbättrar färgen på kött och gör dem mer rödaktiga; Det är emellertid föremål för flera begränsningar för att undvika de toxiska effekterna av detta salt på kroppen.
[TOC]
Kaliumnitritstruktur
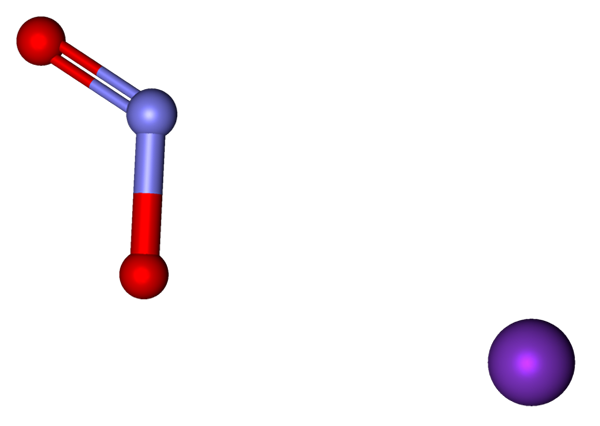 Joner som utgör KNO2 representerad med en modell av sfärer och staplar. Källa: Marinavladivok [CC0].
Joner som utgör KNO2 representerad med en modell av sfärer och staplar. Källa: Marinavladivok [CC0]. De joner som finns i kaliumnitrit visas ovan. Katjonen k+ motsvarar den lila sfären, medan anjonen inte gör det2- Det representeras av blåaktiga och röda sfärer.
Anjonen2- Det visas med en dubbelbindning och en enkel [o = n-o]-; Men i verkligheten är båda länkarna desamma som ett resultat av resonansen av den negativa belastningen mellan dem.
K -jonerna+ och inte2- De lockar varandra i rymden för att organisera ett strukturellt mönster med minst energi; Detta är, där avvisningarna mellan lika belastningar är minimala. Och så tror Kno -kristallerna2, vars enhetscell är mottaglig för temperaturförändringar, vilka fasövergångar.
Kan tjäna dig: Stanislao CannizzaroTill exempel vid låga temperaturer (mindre än 25 ° C) KNO -kristallerna2 Anta ett monokliniskt system (fas I). När temperaturen överstiger 25 ° C inträffar en rhomboébisk monoklinisk fasövergång (fas II). Slutligen, över 40 ° C KNO -kristallerna2 Ändra att vara kubisk (fas III).
Också Kno2 kan uppvisa andra kristallina faser (fas IV, V och VI) under högt tryck. Med detta, kjoner+ och inte2- De slutar flytta och beställde på olika sätt i sina rena kristaller.
Egenskaper
Molekylär massa
85,1038 g/mol.
Densitet
1 9150 g/ml.
Smältpunkt
440,02 ° C (men börjar bryta ner från 350 ° C, emitterande giftiga ångor).
Kokpunkt
537 ° C (explosion).
Vattenlöslighet
312 g/ 100 g vatten vid 25 ° C.
Delicuescens
Dess löslighet i vatten är sådan att den är hygroskopisk; Så mycket, det uppvisar delikoscens, absorberar tillräcklig fukt för att lösa upp. Denna affinitet för vatten kan bero på den energistabilitet som kjoner får+ Vid hydratisering, såväl som en låg kristallin nätverksentalpi för KNO -kristallerna2.
Kristaller kan absorbera vatten utan att lösa upp för att bli ett hydrat2· H2ANTINGEN. I hydrat åtföljer vattenmolekylen jonerna, som modifierar den kristallina strukturen.
Detta hydrat (eller flera av dem) kan bildas under -9 ° C; Vid en högre temperatur upplöses och hydrerar vatten jonerna och deformerar glaset.
Löslighet i andra lösningsmedel
Lite lösligt i heta alkoholer och mycket löslig i ammoniak.
pH
6-9. Dess vattenhaltiga lösningar är därför alkaliska, eftersom anjonen inte gör det2- Det kan hydrolisera.
Nomenklatur
Till kno2 Det kan också namnges på andra sätt. "Kaliumnitrit" motsvarar namnet på detta salt enligt lager nomenklaturen; 'Kaliumnitrito', enligt den systematiska nomenklaturen, där den enda valensen av kalium, +1 framhävs; och dioxonitrat (iii) av kalium, enligt den systematiska nomenklaturen.
Det kan tjäna dig: Dibenzalacetona: egenskaper, reaktionsmekanism, användningar, riskerKalium 'dioxonitrat (iii), belyser valens +3 för kväveatomen. Till och med namnet mest rekommenderat av IuPac för KNO2, "Kaliumnitrit" fortsätter att vara den mest bekväma och det enklaste att komma ihåg.
Erhållande
Det mest direkta sättet att syntetisera det, men med lägre prestanda är genom den termiska sönderdelningen av kaliumnitrat eller saltpeter vid 400 ° C eller mer:
2kno3 => Kno2 + ANTINGEN2
Men en del av Kno2 slutar med att sönderdelas med värme, utöver andra produkter.
En annan metod för att förbereda eller syntetisera den med högre prestanda är genom att minska KNO3 I närvaro av bly, koppar eller zink. Ekvationen för denna reaktion är som följer:
Kno3 + Pb => kno2 + Pbo
Kalium och blynitrat blandas stökiometriskt i en järnpanna, där de smälter samman med konstant omrörning och uppvärmning i en halvtimme. Blyoxid (II) är gul och den resulterande degen är varm och behandlas med kokande vatten. Sedan filtrerar den heta blandningen.
Det heta filteret bubblar med koldioxid i fem minuter, vilket kommer att fälla ut blykarbonat, PBCO3, olöslig. På detta sätt är ledningsledningen klar. Kalpitalsyra utspädd till filtreringen tillsätts tills pH är neutralt, det är tillåtet att svalna och slutligen förångas vattnet så att kristallerna i KNO bildas2.
Ansökningar
Tillsatsmedel och reagens
Kaliumnitrit används som ett tillsats för att bota rött kött, upprätthålla deras smak och mer tidsfärg under lagring, medan försenar bakteriell verkan och vissa toxiner, såsom botulinik. Därför uppvisar den antibakteriell verkan.
Kno2 Det oxiderar inte, som reagerar med myoglobin av köttet och följer följaktligen ändring av dess naturliga röda färg. Sedan, när köttet är kokt, förvärvar det sin karakteristiska starka rosa färg.
Kan tjäna dig: 20 exempel på kemisk sublimering och egenskaperUnder förhållanden utan att specificera KNO2 reagerar med köttproteiner för att ge upphov till nitrosamin, vilket kan bli cancerframkallande.
Å andra sidan, Kno2 (även om det helst nano2) Det är ett analytiskt reagens som kan användas i syntesen av azoiska färgämnen (reaktionen av kvävesyra med aromatiska aminer) och i aminosyranalysen.
Motgift
Medan det har sina negativa effekter, Kno2 Det fungerar som en motgift hos förgiftade patienter med cyanider och vätesulfid. Dess mekanism är att oxidera troens centra2+ till tro3+ av de grupper vi har av hemoglobinerna som producerar metemoglobin, som sedan reagerar med CN -anjonerna- och hs-.
Läkare
I magsjuice i magen gör inte anjonen2- Det reduceras till inte, vilket är känt för att ha vasodilatoråtgärd, vilket ökar blodflödet. I andra regioner i kroppen där pH inte är tillräckligt med syra, är vissa enzymer, såsom oxidorterad Xanthina, ansvariga för att minska icke -2-.
Kno har använts2 Att behandla sjukdomar och sjukdomar som bröst angina och epilepsi (med mycket negativa biverkningar).
Referenser
- Wikipedia. (2019). Kaliumnitrit. Hämtad från: i.Wikipedia.org
- Prebchem. (2016). Förberedelse kaliumnitrit. Återhämtat sig från: prepchem.com
- Mark Gilchrist, Angela C. Strand, Nigel Benjamin. (2011). Oorganisk nitrat och nitrit och kontroll av blodtryck, kardiovaskulär forskning, volym 89, nummer 3, 15 februari 2011, sid 492-498, DOI.org/10.1093/CVR/CVQ309
- Pub. (2019). Kaliumnitrit. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Kemisk formulering. (2018). Kaliumnitrit. Återhämtad från: Quimica -formulering.com
- National Center for Advancing Translational Sciences. (2011). Kaliumnitrit. Återhämtat sig från: droger.ncats.Io
- Richard J. Eley, Paul f. Addis och Joseph J. Wartheen. (1992). Nitrit i kött. University of Minnesota.
- N. R. Rao, b. Prakash och m. Natarajan. (1975). Kristallstrukturomvandlingar i oorganiska nitriter, nitrater och karbonater. Institutionen för kemi, Indian Institute of Technology, Kanpur, Indien.
- « Politiska talegenskaper, typer, frågor och exempel
- Sopor föroreningar orsaker, konsekvenser och exempel »

