Nitrobensen (C6H5NO2) struktur, egenskaper, användningar, risker
- 4599
- 1497
- Johan Gustafsson
han nitrobensen Det är en aromatisk organisk förening som bildas av en bensenisk ring c6H5- Och en nitro -ingen grupp2. Dess kemiska formel är c6H5NEJ2. Det är en färgglad eller ljusgul oljig vätska, med en lukt av bittera mandlar eller en skor för skor.
Nitobensen är en mycket användbar förening i den kemiska industrin eftersom den gör det möjligt att få en serie kemiska ämnen som har varierande användningar. Detta beror på att det kan vara föremål för olika typer av reaktioner.
 Nitrobencene, c6H5-NEJ2. Författare: Marilú Stea.
Nitrobencene, c6H5-NEJ2. Författare: Marilú Stea. Bland de viktiga kemiska reaktionerna är nitrering (vilket gör att du kan lägga till fler grupper -inte2 till molekylen) och reduktionen (motsatsen till oxidation när de två syreatomerna i nitro -gruppen -ingen elimineras2 och ersätts av hydrogener).
Med NitroBencene kan du till exempel förbereda anilin och para-acetaminofenol. Det senare är den välkända acetaminophen som är en antipyretisk (febermedicinering) och mjukt smärtstillande medel (mindre smärtläkemedel).
Nitobensen måste manipuleras med försiktighet eftersom den är irriterande och giftig, det kan orsaka en typ av anemi, bland flera symtom, och det tros att det kan orsaka cancer. Det är också skadligt för miljön.
[TOC]
Strukturera
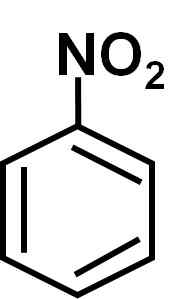
Nitrobensen c6H5-NEJ2 Det är en platt molekyl som bildas av en bensenisk ring c6H5- till vilken en nitro -grupp är länkad -inte2. Dess molekyl är platt eftersom det finns en elektronisk interaktion mellan nitro -ingen grupp2 och bensenringen.
 Platta struktur av nitrobensenmolekylen. Elektronerna i de dubbla bondyan -ringlänkarna tenderar att interagera med nitro -ingen grupp2. Författare: Benjah-Bmm27. Källa: Wikimedia Commons.
Platta struktur av nitrobensenmolekylen. Elektronerna i de dubbla bondyan -ringlänkarna tenderar att interagera med nitro -ingen grupp2. Författare: Benjah-Bmm27. Källa: Wikimedia Commons. Nitro -ingen grupp2 tenderar att locka elektronerna i den benseniska ringen c6H5-.
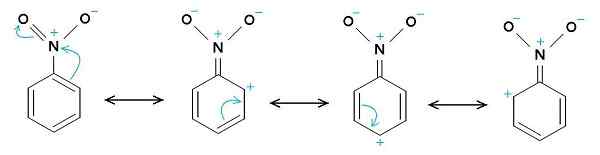 Nitrobensenresonansstrukturer. Benzenringen tenderar att ha en positiv belastning, medan Nitro -No2 -gruppen tenderar att ha en negativ belastning. Den ursprungliga uppladdaren var Samuele Madini på italienska Wikipedia. [Allmängods]. Källa: Wikimedia Commons.
Nitrobensenresonansstrukturer. Benzenringen tenderar att ha en positiv belastning, medan Nitro -No2 -gruppen tenderar att ha en negativ belastning. Den ursprungliga uppladdaren var Samuele Madini på italienska Wikipedia. [Allmängods]. Källa: Wikimedia Commons. Det är därför molekylen har en lite mer negativ sida (där syre av -no är2) och en lite mer positiv sida (bensenringen).
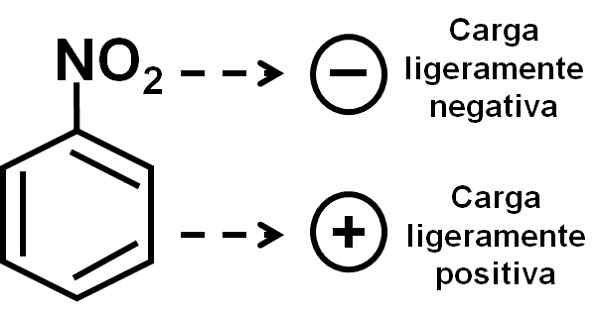 Syre i nitrogruppen har något negativ belastning jämfört med bensenringen. Författare: Marilú Stea.
Syre i nitrogruppen har något negativ belastning jämfört med bensenringen. Författare: Marilú Stea. Nomenklatur
- Nitrobensen.
- Nitrobenze.
- Nitrobensol.
- Olja eller essens av Mirbano eller Mirbana (avstängd term).
Egenskaper
Fysiskt tillstånd
Färgglad oljig vätska till ljusgul.
Molekylvikt
123.11 g/mol.
Smältpunkt
5,7 ºC.
Kokpunkt
211 ºC.
Det kan tjäna dig: koboltklorid (COCL2 (: struktur, nomenklatur, egenskaperFlampunkt
88 ºC (stängd koppmetod).
Självriktningstemperatur
480 ° C.
Densitet
1 2037 g/cm3 vid 20 ºC.
Löslighet
Lite vattenlösligt: 0,19 g/100 g vatten vid 20 ° C. Helt blandbar med alkohol, bensen och dietyleter.
Kemiska egenskaper
Nitrobencen är stabil upp till cirka 450 ° C temperatur där den börjar sönderdelas bildning (i frånvaro av syre) Nej, nej2, Bensen, bifenyl, anilin, dibenzofurano och naftalen.
Bland de viktiga reaktionerna från nitrobencen är reduktion, nitrering, halogenering och sulfonering.
Nitrobensennitrering producerar initialt meta-nitrobensen och med en lång reaktionstid erhålls 1,3,5-nitobensen.
Reagerande brom eller klor med nitrobensen i närvaro av en lämplig katalysator erhålls 3-bromo-nitrobensen (meta-bromonitrobencen) eller 3-kllor-nitrobensen (metakloritrobensen).
Ett exempel på reduktion är att när man hanterar tenn (SN) i saltsyra (HCl) erhålls metakalogenonitobenzener av meta-halogenoanylinerna.
Sulfonationen av nitrobensen utförs med rökande svavelsyra vid 70-80 ° C och produkten är meta-nitrobenzeulfonic meta-nitrobenze. Detta kan reduceras med järn och HCl för att ge metanylsyra.
Dimmerbildning
I en bensenlösning c6H6 Nitrobencenmolekyler är associerade med varandra som bildar diameter eller molekyler. I dessa par är en av molekylerna i en inverterad position med avseende på den andra.
Bildningen av nitrobensendiametrar med molekyler en i en inverterad position med avseende på den andra beror möjligen.
I dimeren är sidan med något mer positiv belastning av en av molekylerna möjligen belägen nära den något negativa belastningen av den andra molekylen, eftersom motsatta belastningar lockas, och så händer det med de andra två sidorna.
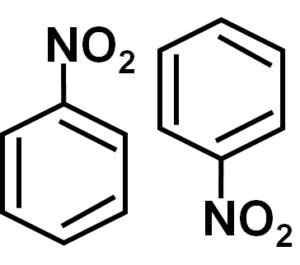 Nitrobencennummer, det vill säga två molekyler som tenderar att vara tillsammans i vissa lösningsmedel. Författare: Marilú Stea.
Nitrobencennummer, det vill säga två molekyler som tenderar att vara tillsammans i vissa lösningsmedel. Författare: Marilú Stea. Andra egenskaper
Den presenterar en lukt som liknar mandlar eller att polera för skor. Genom att sänka dess stelningstemperatur i form av grönaktiga gula kristaller.
Erhållande
Du får behandla bensen c6H6 Med en blandning av salpetersyra hno3 och svavelsyra h2Sw4. Processen kallas nitrering och involverar bildandet av nitroniumjonen inte2+ Tack vare närvaron av svavelsyra h2Sw4.
- Nitroniojon nr2+:
Hno3 + 2 h2Sw4 ⇔ h3ANTINGEN+ + 2 hso4- + NEJ2+ (Nitroniojon)
- Nitroniojonen attackerar bensen:
Kan tjäna dig: Systematiskt fel: Hur man beräknar det, i kemi, i fysik, exempelC6H6 + NEJ2+ → C6H6NEJ2+
- NitroBencene bildas:
C6H6NEJ2+ + Hso4- → C6H5NEJ2 + H2Sw4
Sammanfattningsvis:
C6H6 + Hno3 → C6H5NEJ2 + H2ANTINGEN
Bensennitreringsreaktionen är mycket exoterm, det vill säga mycket värme genereras, så den är mycket farlig.
Ansökningar
För att få anilin och acetaminophen
Nitrobencen används främst för att syntetisera anilin c6H5Nh2, som är en allmänt använt förening för beredning av bekämpningsmedel, tandkött, färgämnen, sprängämnen och mediciner.
Att erhålla anilin sker genom att reducera nitrobensen i surt medium i närvaro av järn eller tenn, som utförs enligt följande steg:
Nitrobensen → nitrosobensen → fenylhydroxylamin → anilin
C6H5NEJ2 → C6H5Nej → C6H5NHOH → C6H5Nh2
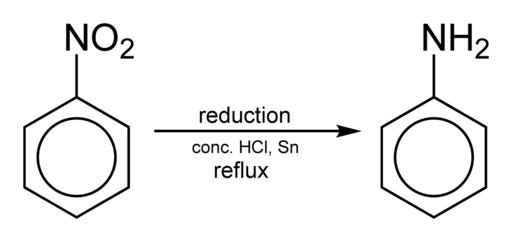 Nitrobencenreduktion för att få anilin. Benjah-Bmm27 [Public Domain]. Källa: Wikimedia Commons.
Nitrobencenreduktion för att få anilin. Benjah-Bmm27 [Public Domain]. Källa: Wikimedia Commons. Beroende på förhållanden kan processen stoppas i ett av mellanstegen till exempel i fenylhydroxylamin. Från fenylhydroxylamin i en starkt sur miljö kan para-aminofenol framställas:
Fenylhdroxylamin → p-Aminofenol
C6H5NHOH → hoc6H4Nh2
Det senare behandlas med ättiksyraanhydrid för att erhålla paracetamol (acetaminophen) en mild antipyretisk och mjuk smärtstillande medel, det vill säga en medicinering för att behandla feber och smärta.
 Ibland är det möjligt att medicinera med acetaminophen till barn med feber. Acetaminophen är ett nitrobensenderivat. Författare: Augusto Ordonez. Källa: Pixabay.
Ibland är det möjligt att medicinera med acetaminophen till barn med feber. Acetaminophen är ett nitrobensenderivat. Författare: Augusto Ordonez. Källa: Pixabay.  Acetaminophen -piller, ett nitrobensenderivat. Paracetamol_acetaminophen_500_mg_pils.JPG: Michelle Tribe från Ottawa, Canadaderivative Work: Anrie [CC av (https: // CreativeCommons.Org/licenser/av/3.0)]. Källa: Wikimedia Commons.
Acetaminophen -piller, ett nitrobensenderivat. Paracetamol_acetaminophen_500_mg_pils.JPG: Michelle Tribe från Ottawa, Canadaderivative Work: Anrie [CC av (https: // CreativeCommons.Org/licenser/av/3.0)]. Källa: Wikimedia Commons. Ett annat sätt att erhålla anilin är genom att reducera nitrobensen med kolmonoxid (CO) i vattenhaltigt medium i närvaro av mycket små partiklar (nanopartiklar) av paladium (PD) som katalysator.
C6H5-NEJ2 + 3 co + h2O → C6H5-Nh2 + 3 Co2
För att erhålla andra kemiska föreningar
Nitobensen är utgångspunkten för att få en mängd olika föreningar som används såsom färgämnen, bekämpningsmedel, mediciner och kosmetika.
 Vissa färgämnen erhålls tack vare nitrobensen. Författare: Edith Lüthi. Källa: Pixabay.
Vissa färgämnen erhålls tack vare nitrobensen. Författare: Edith Lüthi. Källa: Pixabay. Till exempel tillåter det att erhålla 1,3-dinitrobencen att genom klorering (tillsats av klor) och reduktion (eliminering av syreatomer) genererar 3-kloroanylin. Detta används som mellanhand för bekämpningsmedel, färgämnen och läkemedel.
Nitobenzen användes för att framställa benchidin som är ett färgämne. Dessutom tjänar nitrobensen till att framställa kinolin, azobensen, metanylsyra, dyitobensen, isocianat eller pyroxilin bland många andra föreningar.
I flera applikationer
Nitobensen används eller används som:
Kan tjäna dig: omättade kolväten- Extraktionslösningsmedel för rening av smörjoljor som används i maskiner
- Lösningsmedel för cellulosaetrar
- Blandningsingrediens till polska metaller
- I tvålar
- I blandningar för polska skor
- Sprayfärgkonservator
- Golvpoleringsblandningskomponent
- Mandel Essence ersättare
- I parfymindustrin
- Vid produktion av syntetiskt gummi
- Lösningsmedel i olika processer
 Nitobensen är en del av några blandningar för att polera skor. D-Kuru [CC BY-SA 3.0 på (https: // CreativeCommons.Org/licenser/BY-SA/3.0/at/gärning.i)]. Källa: Wikimedia Commons.
Nitobensen är en del av några blandningar för att polera skor. D-Kuru [CC BY-SA 3.0 på (https: // CreativeCommons.Org/licenser/BY-SA/3.0/at/gärning.i)]. Källa: Wikimedia Commons. Risker
Nitobensen är giftig genom inandning, intag och absorption genom huden.
Irriterar huden, ögonen och luftvägarna. Det kan orsaka en typ av anemi som kallas metemoglobinemi som består i att minska förmågan hos röda blodkroppar att frigöra syre i vävnader och generera trötthet.
Dessutom orsakar NitroBencene dyspné, yrsel, upprörd syn, brist på andetag, kollaps och död. Det skadar också levern, mjälten, njurarna och centrala nervsystemet.
Det uppskattas att det kan vara ett mutagen och eventuellt orsaka mänsklig cancer, eftersom det har orsakat det hos djur.
Dessutom bör nitrobencen inte kasseras i miljön. Dess toxicitet mot djur, växter och mikroorganismer gör det mycket skadligt för ekosystem.
Toxicitet mot mikroorganismer minskar dess biologiskt nedbrytbarhet.
Behandlingar för att eliminera miljön
Föroreningar av miljön med nitrobencen kan uppstå genom avfallet från de olika branscherna som använder den, till exempel färgindustrin eller sprängämnen.
Nitobensen är en mycket giftig och svår att bryta ner under naturliga förhållanden, av detta skäl kan det orsaka svår dricksföroreningar och sådd av bevattningssystem.
På grund av dess höga stabilitet och toxicitet gentemot mikroorganismer väljs den ofta som modell i avloppsbehandlingsstudier.
Olika sätt undersöks för att eliminera förorenat vatten nitrobensen. En av dem är genom fotokatalytisk nedbrytning, det vill säga att använda solljus som en accelerator för nedbrytningsreaktionen i närvaro av titandioxid av titandum2.
 Med en solljusreaktor är det möjligt att eliminera vattenföroreningar med NitroBencene. Mihai-cosmin pascariu [cc by-sa (https: // creativecommons.Org/licenser/BY-SA/4.0)]. Källa: Wikimedia Commons.
Med en solljusreaktor är det möjligt att eliminera vattenföroreningar med NitroBencene. Mihai-cosmin pascariu [cc by-sa (https: // creativecommons.Org/licenser/BY-SA/4.0)]. Källa: Wikimedia Commons. Mikroelektrolysmetoder har också testats framgångsrikt med en järnkatalysator (tro) och koppar (CU) i keramik. Mikroelektrolys gör att nitrobensen kan sönderdelas genom en elektrisk ström.
Referenser
- ELLER.S. National Library of Medicine. (2019). Nitrobensen. Återhämtat sig från pubchem.Ncbi.Nlm.Nih.Gov.
- Morrison, r.T. och Boyd, r.N. (2002). Organisk kemi. Sjätte upplagan. Prentice-hall.
- Moldaveanu, s.C. (2019). Pyrolys av andra kväve-räkningar föreningar. I pyrolys av organiska molekyler (andra upplagan). Återhämtat sig från Scientedirect.com.
- Smith, s.W.G. et al. (1969). Aromatiska nitrationsnitroföreningar. Elektrofila substitutioner. I aromatisk kemi. Återhämtat sig från Scientedirect.com.
- Windholz, m. et al. (redaktörer) (1983). Merck -indexet. En enyklopedi av kemikalier, droger och biologiska. Tionde upplagan. Merck & Co., Inkl.
- Ullmanns Encyclopedia of Industrial Chemistry. (1990). Femte upplagan. Volym A22. VCH Verlagsgellschaft MBH.
- Whang, T.-J. et al. (2012). UV-regadierad fotokatalytisk nedbrytning av nitrobensen med titanbindning på kvartsröret. International Journal of Photoenergy, Volym 2012, Artiklar ID 681941. Hyndawi återhämtade sig.com.
- Shikata, T. et al. (2014). Nitrobensen anti-parallell dimerbildning i icke-polära lösningsmedel. AIP Advances 4, 067130 (2014). Återhämtat sig från doaj.org.
- Krogul-obczak, a. et al. (2019). Reduktion av nitrobensen till anilin av CO/H2Eller i vittnet om palladium -nanopartiklar. Katalysatorer 2019, 9, 404. MDPI återhämtade sig.com.
- Yang, b. et al. (2019). Pilotskalaproduktion, egenskaper och tillämpning av Fe/Cu-katalytisk-ceramic-fyllare för nitrobensenföreningar avloppsrening. Katalysatorer 2019, 9, 11. MDPI återhämtade sig.com.
- « Mekanisk fördelformel, ekvationer, beräkning och exempel
- 110 Eviga kärleksfraser för pojkvänner och män »

