Natriumoxalat (Na2C2O4) struktur, egenskaper, användningar, risker

- 4132
- 1112
- Johan Johansson
han natriumoxalat Det är en organisk förening bildad av två natriumjoner och en oxalatjon. Dess kemiska formel är na2C2ANTINGEN4 eller också na2(KUTTRA)2. Det är natriumsaltet av oxalsyra eller etanodioinsyra. Då en2C2ANTINGEN4 Det är ett kristallint vitt fast ämne och dess vattenhaltiga lösningar är grundläggande (alkaliska).
Natriumoxalat finns i växter och grönsaker. Hos människan genereras den naturligt från dess konjugerade syra oxalsyra, som i sin tur produceras av vissa metaboliska processer.
 Natriumoxalat Na2(KUTTRA)2 fast. Lem [cc by-sa 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]. Källa: Wikimedia Commons.
Natriumoxalat Na2(KUTTRA)2 fast. Lem [cc by-sa 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]. Källa: Wikimedia Commons. Då en2C2ANTINGEN4 Det används i kemiska analyslaboratorier som ett reducerande medel (motsatsen till oxidant). Också för att tillåta tester till vissa organiska föreningar under avloppsrening.
Det har använts för eliminering av klorfluorkolvävnad (CGC), som skadar ozonskiktet. Det är också råmaterial att få oxalsyra på ett ekonomiskt sätt.
På grund av det höga natriumoxalatinnehållet i vissa ätliga grönsaker bör människor som har en tendens att bilda beräkningar eller njursten undvika att konsumera sådana livsmedel. Detta beror på att stenarna i allmänhet bildas med oxalater.
[TOC]
Strukturera
Natriumoxalat består av två natrium Na -katjoner+ och en oxalatanjon (COO)22-. Oxalatanjon bildas i sin tur av två COO- Gick med de två kolatomerna: -Ooc-coo-.
I fast natriumoxalat har oxalatanjon en platt form. Detta innebär att både kol och syre finns i samma plan.
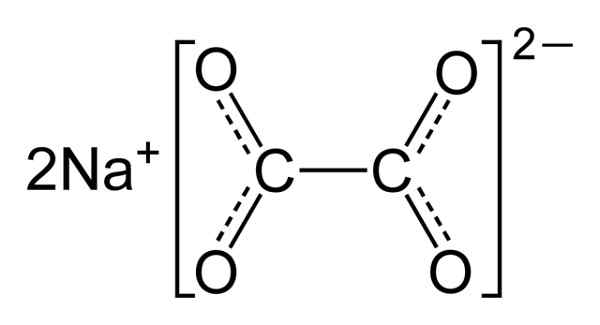 Kemisk struktur av natriumoxalat2(KUTTRA)2. Författare: Benjah-Bmm27. Källa: Wikimedia Commons.
Kemisk struktur av natriumoxalat2(KUTTRA)2. Författare: Benjah-Bmm27. Källa: Wikimedia Commons. Nomenklatur
- Natriumoxalat
- Dysodio oxalat
- Natriumsalt av etanodiosyra
Egenskaper
Fysiskt tillstånd
Kristallint vitt fast ämne.
Molekylvikt
134,0 g/mol
Densitet
2,27 g/cm3 vid 20 ° C.
Löslighet
Vattenlöslig: 3,7 g/100 ml vid 20 ° C.
pH
Dess vattenhaltiga lösningar är grundläggande (alkaliska) eftersom oxalatjonen tenderar att ta vattenprotoner som lämnar jonerna oh fria-.
Kan tjäna dig: neon: historia, egenskaper, struktur, risker, användningarKemiska egenskaper
Det kan neutralisera syror och reaktioner är exotermiska, det vill säga de ger av värme.
Det fungerar som ett reducerande medel och i dessa reaktioner genererar det koldioxid CO2.
Det har egenskapen att gå med i flera metalljoner som järnjonjoner för järnjonjoner2+ och Feric Faith3+.
Erhållande
Enligt en källa som konsulteras kan natriumoxalat erhållas oxiderande syre eller2 Vid en temperatur av cirka 250 ° C i en koncentrerad lösning av NaOH -natriumhydroxid.
Närvaro
Natriumoxalat finns i många växter och grönsaker, såsom chard, spenat och ruibarbo, och i korn som sojabönor, bland många andra växtprodukter.
 Spenat har mycket natriumoxalat. Författare: Aline Ponce. Källa: Pixabay.
Spenat har mycket natriumoxalat. Författare: Aline Ponce. Källa: Pixabay. Dess konjugerade syra oxalsyra sker i den mänskliga organismen genom metabolismen av glykolsyra eller askorbinsyra. När den har producerats metaboliseras den, men utsöndras av oxalatformad urin.
 Ruibarbo innehåller natriumoxalat. Författare: s. Hermann & F. Rikter. Källa: Pixabay.
Ruibarbo innehåller natriumoxalat. Författare: s. Hermann & F. Rikter. Källa: Pixabay. Ansökningar
I kemiska analyslaboratorier
Det används som ett kemiskt reagens, vanligtvis som ett reducerande medel, till exempel för standardisering av kaliumpermanganatlösningar, det vill säga för att bestämma exakt hur mycket natriumpermanganat de har.
I förstörelsen av klorfluorkolväten
Natriumoxalat har använts för förstörelse av klorfluorkolväten (CFC). Dessa CFC -föreningar har varit en av de ansvariga för förstörelsen av planetens ozonskikt (som skyddar oss från ultraviolett strålning).
1996 föreslog vissa forskare användning av natriumoxalat för att eliminera dem, eftersom det lätt reagerar med CFC vid temperaturer av 270-290 ° C, vilket gjorde dem ofarliga produkter mot ozonskiktet.
Natriumoxalatreaktion med CFC: er kan kontrolleras för att erhålla halogenerade aromatiska kolväten som inte är skadliga för ozonskiktet men är användbara föreningar i den kemiska industrin.
Det kan tjäna dig: propylenglykol: struktur, egenskaper, syntes och användningarDenna reaktion kan också föras till det maximala och omvandla hela CFC till NAF -natriumfluorid, sollatriumklorid, elementärt kol och koldioxid CO2.
 Planetens ozonskikt skyddar oss från de ultravioletta strålarna i solen. Natriumoxalat låter dig eliminera CFC -föreningarna som skadar det. Författare: One94. Källa: Pixabay.
Planetens ozonskikt skyddar oss från de ultravioletta strålarna i solen. Natriumoxalat låter dig eliminera CFC -föreningarna som skadar det. Författare: One94. Källa: Pixabay. Vid bestämning av viktiga parametrar i avloppsrening
Det har visat sig att natriumoxalat är användbart för att mäta mängden och klasserna av organiska föreningar som utsöndrar slamens mikroorganismer som används för att behandla avloppsvatten.
Måttet på sådana föreningar är viktigt för att bestämma deras funktion under behandlingen av avloppsvatten, eftersom lättheten att separera leran från vattnet beror på dem.
Med hjälp av natriumoxalat undviks besvären med andra metoder.
För att erhålla oxalsyra
Rå natriumoxalat från avfall från vissa processer har använts för att producera oxalsyra h2C2ANTINGEN4 i stora mängder.
Metoden använder slam från Bayer -processen för att behandla bauxit (ett aluminiummineral). I Bayer -processen behandlas bauxit med NaOH -natriumhydroxid för att lösa upp aluminiumoxiden i detta mineral.
I processen att lösa aluminiumoxid attackeras vissa organiska föreningar i mineralet såsom huminsyror av NaOH, vilket genererar en stor mängd natriumoxalat Na2C2ANTINGEN4.
Detta natriumoxalat är integrerat i en lera med aluminiumföreningar. För att rena den är enheten upplöst, den filtreras och passeras genom en surt jonbytespelare.
I kolumnen finns ett RSO -sulfonsyraharts3H där Na -metalljoner byts ut+ av vätejoner h+, Så du får oxalsyra h2C2ANTINGEN4.
Rso3H + na2C2ANTINGEN4 ⇔ RSO3Na + nahc2ANTINGEN4
Kan tjäna dig: kaliumkarbonat (k2co3): struktur, egenskaper, användningar, erhållningRso3H + NAHC2ANTINGEN4 ⇔ RSO3Na + h2C2ANTINGEN4
Detta är en ekonomisk process och den erhållna oxalsyran är av acceptabel renhet.
För att ta bort oönskade föreningar
Konjugerad natriumoxalatsyra, oxalsyra h2C2ANTINGEN4, Det används för att lösa upp vissa typer av avfall och inlägg.
Oxalsyran som kännetecknar att bli oxalat används som ett komplex eller utfällningsmedel till exempel under bearbetning av avfall från olika kärnkraftsbränslen.
Oxalsyran används också för att ta bort inlagorna av mineraler och järnoxider i rör och annan utrustning, detta beror på dess förmåga att starkt gå med i järnhaltig jon tro2+ Som järnjon tro3+ bildande oxalater.
Risker
Om natriumoxalat inhaleras eller intas direkt. Det producerar kräkningar, svår rensning, svag puls, hjärtkollaps, neuromuskulära symtom och njurskador.
Människor som har en tendens att bilda beräkningar i njurarna på grund av ackumulering av oxalat i urinen bör undvika att konsumera grönsaker med ett högt innehåll av lösliga oxalater som natrium.
Natriumoxalat i höga mängder mat när du når urin binder till kalcium som finns i detta och kan producera beräkningar eller stenar av kalciumoxalat i njurarna till människor som har en tendens att göra det.
 Natriumoxalat av vissa livsmedel kan leda till bildning av stenar i njurarna hos människor med predisposition till det. Författare: Azwer. Källa: Pixabay.
Natriumoxalat av vissa livsmedel kan leda till bildning av stenar i njurarna hos människor med predisposition till det. Författare: Azwer. Källa: Pixabay. Referenser
- ELLER.S. National Library of Medicine. (2019). Natriumoxalat. Nationellt centrum för bioteknikinformation. Återhämtat sig från pubchem.Ncbi.Nlm.Nih.Gov.
- Chai, w. Och Liebman, m. (2005). Effekt av olika matlagningsmetoder på vegetabiliskt oxalatinnehåll. J. Jordbruks-. Matkeme. 2005, 53, 3027-3030. Återhämtat sig från pubar.ACS.org.
- Dagani, r. (nitton nittiosex). CFC förstör Reion. Chemical & Engineering News Archive 1996, 74, 4, 6-7. Återhämtat sig från pubar.ACS.org.
- Sajad, m. och Kim, K.S. (2016). Extraktion av extracellulära polymera ämnen från aktiverat slam med natriumoxalat. Int. J. Miljö. Sci. Teknol. 13, 1697-1706 (2016). Länk återhämtat sig.Kandare.com.
- Jeffrey, g.TILL. Och parry, g.S. (1954). Kristallstrukturen i natriumoxalat. J. A.M. Kem. Soc. 1954, 76, 21, 5283-5286. Återhämtat sig från pubar.ACS.org.
- Okuwaki, a. et al. (1984). Produktion av oxalat genom oxidation av kol med syre i en koncentrerad natriumhydroxidlösning. Ind. Göra. Kem. Driva. Nötkött. Dev. 1984, 23, 648-651. Återhämtat sig från pubar.ACS.org.
- Hefter, g. et al. (2018). Soluubilitet av natriumoxalat i koncentrerade elektrolytlösningar. J Chem & Eng -data. 2018, 63, 3, 542-552. Återhämtat sig från pubar.ACS.org.
- La k. Yo. (1992). Process för framställning av oxalsyra och natriumväteoxalat från rå natriumoxalat. ELLER.S. Patent nr 5 171 887. Dec.15, 1992. Hämtad från Freepatentssonline.com.
- « Haptes historia, funktioner, egenskaper, inmunes svar
- Natriumtripolifosfat (Na5P3O10) struktur, egenskaper, användningar, påverkan »

