Syreegenskaper, struktur, risker, användningar

- 1335
- 338
- Karl Johansson
han syre Det är ett kemiskt element som representeras av symbolen eller. Det är en mycket reaktiv gas, som leder grupp 16: Calcogens. Detta namn beror på att svavel och syre finns i nästan alla mineraler.
Dess höga elektronegativitet förklarar sin stora aviditet av elektroner, vilket leder till att kombinera med ett stort antal element; Så här uppstår ett brett utbud av mineraloxider som berikar jordskorpan. Således komponerar de återstående syre och gör atmosfären andas.
 Syre är vanligtvis synonymt med luft och vatten, men det finns också i stenar och mineraler. Källa: Pxhere.
Syre är vanligtvis synonymt med luft och vatten, men det finns också i stenar och mineraler. Källa: Pxhere. Syre är det tredje elementet i överflöd i universum, bakom väte och helium, och är också den huvudsakliga massa beståndsdelen av jordens cortex. Den har en volymprocent på 20,8% av jordens atmosfär och representerar 89% av massan av vatten.
Den har vanligtvis två allotropiska former: diatomiskt syre (eller2), som är det vanligaste sättet och ozon (eller3), finns i stratosfären. Det finns dock två andra (eller4 Jag8) som finns i dess vätska eller fasta faser och under enorma tryck.
Syre produceras ständigt genom fotosyntesprocessen, utförd av fytoplankton och markväxter. När den har producerats släpps den så att levande varelser kan använda den, medan en liten del av den upplöses i havet, vilket stödjer vattenlevande liv.
Det är därför ett väsentligt element för levande varelser; Inte bara för att det finns i de flesta föreningar och molekyler som bildar dem, utan också ingriper i alla deras metaboliska processer.
Även om dess isolering kontroversiellt tillskrivs Carl Scheele och Joseph Priestley 1774, finns det indikationer på att syre faktiskt isolerades för första gången 1608 av Michael Sendivogius.
Denna gas används i medicinsk praxis för att förbättra levnadsvillkoren för patienter med andningssvårigheter. På samma sätt används syre för att låta människor uppfylla sina funktioner i miljöer där det minskas eller ingen tillgång till atmosfäriskt syre.
Kommersiellt producerat syre används huvudsakligen i den metallurgiska industrin för järnomvandling till stål.
[TOC]
Historia
Nitroarial ande
1500, Leonardo da Vinci, baserat på experimenten av Philo de Byzantium som hölls under andra århundradet till. C., Han drog slutsatsen att en del av luften konsumerades under förbränning och andning.
1608 visade Cornelius Drebble att värmerum (silvernitrat, Kno3) En gas inträffade. Denna gas, som det skulle vara känt senare, var syre; Men Drebble kunde inte identifiera det som ett nytt element.
Sedan, 1668, påpekade John Majow att en del av luften som han kallade "Spiritus nitroaerus" var ansvarig för eld och att den också konsumerades under andning och förbränning av ämnen. Majow konstaterade att ämnen inte ordnade i frånvaro av nitroarial anda.
Majoow utförde antimonförbränningen och observerade en ökning av antimonens vikt under hans förbränning. Sedan drog Majow slutsatsen att antimon i kombination med den nitroariella andan.
Upptäckt
Även om han inte fick erkännande från det vetenskapliga samfundet, i livet eller efter hans död, kommer Michael Sandivogius (1604) sannolikt att vara den verkliga upptäckaren av syre.
Sandivogius var en alkemist, filosof och svensk läkare som producerade den termiska nedbrytningen av kaliumnitrat. Hans experiment ledde honom till frisläppandet av syre, som han kallade "Cibus vitae": livsmedelsmat.
Mellan 1771 och 1772 värmde den svenska kemisten Carl W Scheele flera föreningar: kaliumnitrat, manganoxid och kvicksilveroxid. Scheele observerade att en gas som ökade förbränningen släpptes från dem, och som han kallade "Fire Air".
Joseph Priestly Experiments
1774 värmde den engelska kemisten Joseph Priestly Mercury Oxide genom att använda en tolv -tums ökningslins som koncentrerade solljus. Kvicksilveroxid släppte en gas som fick ljuset att bränna mycket snabbare än normalt.
Dessutom testade präst den biologiska effekten av gas. För att göra detta placerade han i en stängd behållare en mus som han förväntade sig överleva femton minuter; Men i närvaro av gas överlevde han en timme, mer än han uppskattade.
Priestly publicerade sina resultat 1774; Medan Scheele gjorde det 1775. Av denna anledning tillskrivs vanligtvis upptäckten av syre till präst.
Syre i luften
Antoine Lavoisier, en fransk kemist (1777), upptäckte att luften innehåller 20% syre och att när ett ämne brinner, det faktiskt kombineras med syre.
Lavoisier drog slutsatsen att den uppenbara viktökningen som ämnen upplevde under förbränning berodde på den viktminskning som inträffar i luften; Eftersom syre kombinerades med dessa ämnen och därför bevarades massorna av reaktanterna.
Detta gjorde det möjligt för Lavoisier att fastställa lagen om bevarande av materia. Lavoisier föreslog namnet på syre som kom från roten "oxys" syra och "gener" bildning. Då betyder syre 'syra tidigare'.
Detta namn är fel, eftersom inte alla syror innehåller syre; Till exempel vätehalogenider (HF, HCL, HBR och HI).
Dalton (1810) tilldelades vattnet den kemiska formeln HO och därför var den atomvikten av syre 8. En grupp kemikalier, inklusive: Davy (1812) och Berzelius (1814) korrigerade Daltons strategi och drog slutsatsen att den korrekta formeln för vattnet är h2O och den atomiska vikten av syre är 16.
Kan tjäna dig: Disioniserat vattenFysiska och kemiska egenskaper
Utseende
Färglös, toalett och smaklös gas; Medan ozon har en tunnland lukt. Syre gynnar förbränning, men i sig är det inte ett bränsle.
 Byte av syre. Källa: Staff Sgt. Nika Glover, U.S. Flygvapen [allmän domän]
Byte av syre. Källa: Staff Sgt. Nika Glover, U.S. Flygvapen [allmän domän] I sin flytande form (övre bild) är den ljusblå, och dess kristaller är också blåaktig; Men de kan skaffa rosa, orange och till och med rödaktiga toner (som kommer att förklaras i avsnittet av dess struktur).
Atomvikt
15 999 U.
Atomantal (z)
8.
Smältpunkt
-218,79 ºC.
Kokpunkt
-182,962 ºC.
Densitet
Under normala förhållanden: 1 429 g/l. Syre är en tätaste gas än luft. Dessutom är det en dålig ledare av värme och el. Och vid dess kokpunkt (vätska) är densiteten 1 141 g/ml.
Trippelpunkt
54,361 K och 0,1463 kPa (14,44 atm).
Kritisk punkt
154,581 K och 5,043 MPa (49770,54 ATM).
Fusionsvärme
0,444 kJ/mol.
Förångningsvärme
6,82 kJ/mol.
Molorisk kapacitet
29 378 J/(mol · k).
Ångtryck
Vid en temperatur på 90 K har ett ångtryck på 986,92 atm.
Oxidationstillstånd
-2, -1, +1, +2. Den viktigaste oxidationsstatusen är -2 (eller2-).
Elektronnegativitet
3.44 på Pauling -skalan
Joniseringsenergi
Först: 1.313,9 kJ/mol.
Andra: 3.388,3 kJ/mol.
Tredje: 5.300,5 kJ/mol.
Magnetisk ordning
Paramagnetisk.
Vattenlöslighet
Syrelösligheten i vatten minskar när temperaturen ökar. Till exempel: 14,6 ml syre/L vatten löses vid 0 ºC och 7,6 ml syre/L vatten vid 20 ºC. Lösligheten för syre i dricksvatten är större än i havsvatten.
I temperaturtillståndet 25 ºC och vid ett tryck 101,3 kPa kan dricksvattnet innehålla 6,04 ml syre/L vatten; Medan havsvatten bara 4,95 ml syre/L vatten.
Reaktivitet
Syre är en mycket reaktiv gas som reagerar direkt med nästan alla element vid rumstemperatur och höga temperaturer; Förutom metaller med högre reduktionspotentialer än koppar.
Du kan också reagera med föreningarna och oxidera de element som finns i dem. Detta är vad som händer när det reagerar med glukos, till exempel för att producera vatten och koldioxid; eller när träet eller ett kolväte brinner.
Syre kan acceptera elektroner genom fullständig eller partiell överföring, så det betraktas som ett oxidationsmedel.
Det vanligaste oxidationsnummer eller oxidationsstatus är -2. Med detta oxidationsnummer finns det i vattnet (h2O), svaveldioxid (så2) och koldioxid (CO2).
Även i organiska föreningar såsom aldehyder, alkoholer, karboxylsyror; vanliga syror som h2Sw4, H2Co3, Hno3; och i dess härledda salter: na2Sw4, Na2Co3 OK Nej3. I dem alla kunde O -existensen antas2- (vilket inte är sant för organiska föreningar).
Oxider
Syre är närvarande som eller2- I de kristallina strukturerna av metalloxider.
Å andra sidan, i metall superoxider, såsom kaliumsuperoxid (KO2), syre är som jon eller2-. Medan i metallperoxider, för att säga bariumperoxid (Bao2), syre presenteras som jon eller22- (BA2+ANTINGEN22-).
Isotoper
Syre har tre stabila isotoper: 16Eller, med 99,76% överflöd; han 17Eller, med 0,04%; och den 18Eller, med 0,20%. Observera att han 16Eller det är den överlägset mest stabila och rikliga isotopen.
Elektronisk struktur och konfiguration
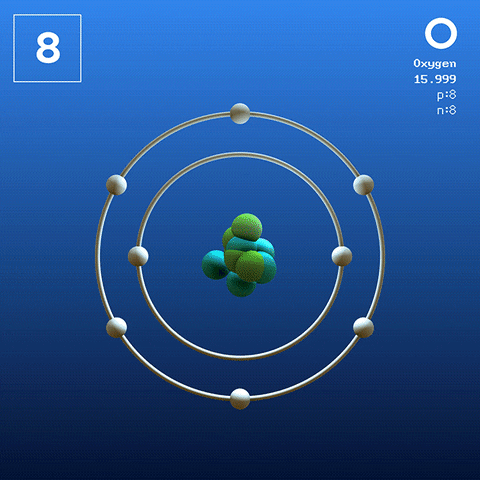
Syremolekyl och interaktioner
 Syremolekyl. Källa: Claudio Pistilli [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]
Syremolekyl. Källa: Claudio Pistilli [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] Syre i sitt basala tillstånd är en atom vars elektroniska konfiguration är:
[Han] 2s2 2 p4
Enligt Valencia Link Theory (TEV) är två syreatomer kopplade kovalent så att båda separat slutför sin oktett av Valencia; Förutom att de kan para sina två ensamma elektroner av orbitalerna 2p.
På detta sätt visas syretomisk molekyl, eller2 (Högre bild), som har en dubbelbindning (O = O). Dess energistabilitet är sådan att syre aldrig finns som enskilda atomer i gasformiga fasen utan som molekyler.
Eftersom O2 Han är homonukleär, linjär och symmetrisk, saknar permanent dipolmoment; Därför beror dess intermolekylära interaktioner på dess molekylmassa och London -spridningskrafterna. Dessa krafter är relativt svaga för syre, vilket förklarar varför det är en gas under markförhållanden.
Men när temperaturen sjunker eller ökar trycket, molekylerna eller2 De tvingas sammanhängande; till punkten att deras interaktioner blir betydande och tillåter bildning av vätska eller fast syre. För att försöka förstå dem molekylärt är det nödvändigt att inte tappa sikten på o2 Som strukturell enhet.
Ozon
Syre kan anta andra betydligt stabila molekylstrukturer; Det vill säga det finns i naturen (eller inom laboratoriet) i olika allotropiska former. Ozonet (nedre bilden), eller3, Till exempel är det den andra alotropen för det mest kända syre.
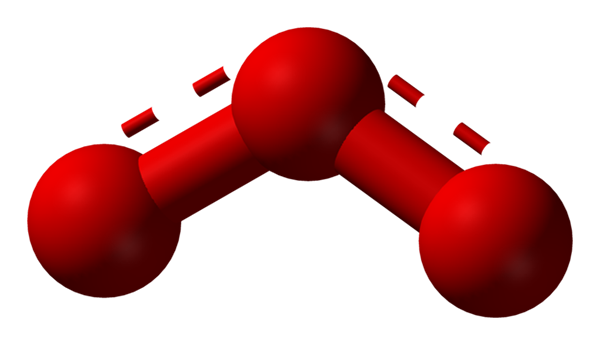 Struktur av resonanshybrid representerad av en modell av sfärer och staplar för ozonmolekylen. Källa: Ben Mills via Wikipedia.
Struktur av resonanshybrid representerad av en modell av sfärer och staplar för ozonmolekylen. Källa: Ben Mills via Wikipedia. Återigen håller TEV, förklarar och demonstrerar det i OR3 Det måste finnas resonansstrukturer som stabiliserar den positiva formella belastningen på mitten av syre (linjer prickade i rött); Medan syre från slutet av boomerang är en negativ belastning fördelad, vilket orsakar den totala belastningen för ozon.
Kan tjäna dig: Löslighetsregler: Allmänna aspekter och reglerPå detta sätt är länkarna inte enkla, men inte dubbla. Exempel på resonanshybrider är mycket vanliga i så många molekyler eller oorganiska joner.
O2 Jag3, Som ett resultat att deras molekylstrukturer är olika gäller samma för deras fysiska och kemiska egenskaper, vätskefaser eller kristallfaser (även om båda konsumerar syreatomer). De teoretiserar den syntesen i stora skalor av cyklisk ozon är troligt, vars struktur liknar den för en rödaktig och syresatt triangel.
Hittills anländer de "normala alotroperna" av syre. Det finns dock två andra att tänka på: o4 Jag8, hittas eller föreslås i vätska respektive fast syre.
Byte av syre
Gasiskt syre är färglöst, men när temperaturen går ner till -183 ºC, kondenseras i en ljusblå vätska (himmelsk liknande). Interaktioner mellan molekyler eller2 Det är nu som även deras elektroner kan absorbera fotoner i det röda området i det synliga spektrumet för att återspegla dess karakteristiska blå färg.
Det har emellertid teoretiserats att det i denna vätska finns mer än enkla molekyler eller2, men också en molekyl eller4 (lägre bild). Det verkar som om ozonen hade "fastnat" en annan syreatom som på något sätt ingick av den nyligen beskrivna formella formella belastningen.
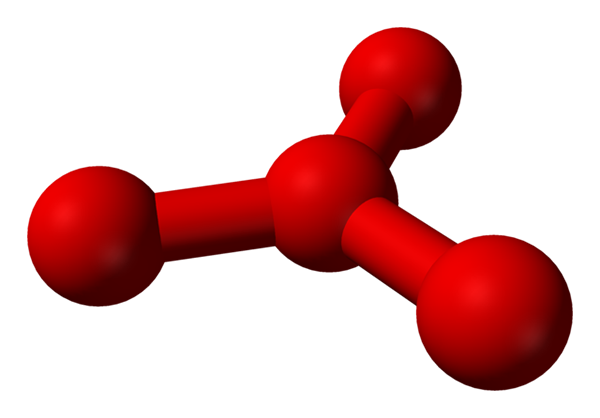 Modellens föreslagna struktur med sfärer och staplar för tetraoxygenmolekylen. Källa: Benjah-Bmm27 [Public Domain]
Modellens föreslagna struktur med sfärer och staplar för tetraoxygenmolekylen. Källa: Benjah-Bmm27 [Public Domain] Problemet är att enligt dator- och molekylsimuleringar, nämnda struktur för O4 Det är inte exakt stabilt; De förutspår emellertid att de finns som enheter (eller2)2, det vill säga två molekyler av O2 De närmar sig så mycket att de bildar en slags oregelbunden ram (atomer eller inte är i linje med varandra).
Solid syre
När temperaturen går ner till -218,79 ºC, kristalliseras syre i en enkel kubisk struktur (y -fas). När temperaturen sjunker ännu mer lider kubikglaset övergångar till p -faserna (Rhomboédica och vid -229,35 ºC) och a (monokliniskt och vid -249,35 ºC).
Alla dessa kristallina faser av fast syre förekommer vid omgivningstryck (1 atm). När trycket ökar till 9 GPa (~ 9000 atm) visas 5 -fasen, vars kristaller är orange. Om trycket fortsätter att öka till 10 GPa visas det röda fasta syre eller fas ε (igen monokliniskt).
Fas ε är speciellt eftersom trycket är så enormt att molekyler eller2 De rymmer inte bara som enheter eller4, men också eller8:
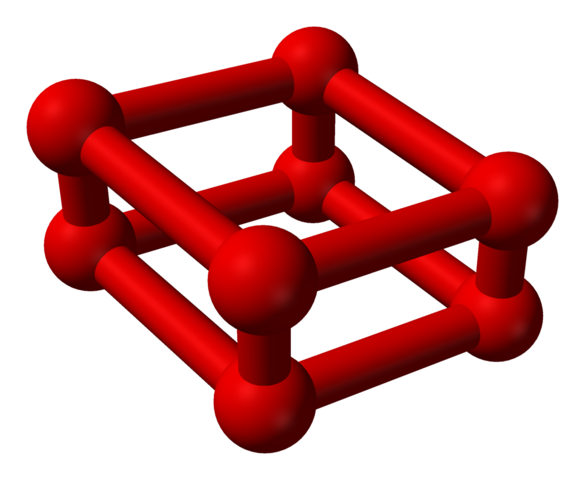 Modellstruktur med sfärer och staplar för octaoxygenmolekyl. Källa: Benjah-Bmm27 [Public Domain]
Modellstruktur med sfärer och staplar för octaoxygenmolekyl. Källa: Benjah-Bmm27 [Public Domain] Observera att detta eller8 Den består av två enheter eller4 där den oregelbundna ramverket redan förklarats. Det är också giltigt att betrakta det som fyra eller2 nära inriktade och i vertikala positioner. Emellertid är dess stabilitet sådan under detta tryck att OR4 Jag8 De är ytterligare två alotroper för syre.
Och slutligen har vi fasen ζ, metallisk (till tryck större än 96 GPa), där trycket gör elektroner spridda i glaset; Som med metaller.
Var är och produktion
Mineraler
Syre är i massa det tredje elementet i universum, bakom väte och helium. Det utgör det vanligaste elementet i jordskorpan, som representerar cirka 50% av dess massa. Det är främst kombinerat med kisel, i form av kiseloxid (SIO2).
Syre är en del av otaliga mineral. På samma sätt är det beläget som en del av många föreningar som karbonater, fosfater, sulfater, nitrater, etc.
Luft
Syre utgör 20,8% av atmosfärisk luft i volym. I troposfären är det främst som en diatomisk syremolekyl. Medan i stratosfären är ett gasformigt skikt mellan 15 och 50 km av jordens yta som ozon.
Ozon produceras av en elektrisk chock på molekylen i O2. Denna alotrop av syre absorberar det ultravioletta ljuset av solstrålning och blockerar dess skadliga verkan på människor, som i extrema fall är förknippade med melanomens utseende.
Färskt och salt vatten
Syre är en huvudkomponent i havsvatten och färskt vatten från sjöar, floder och grundvatten. Syre är en del av den kemiska formeln för vatten och masserar 89% av det.
Å andra sidan, även om lösligheten av syre i vattnet är relativt låg, är mängden syre som är upplöst i detta avgörande för vattenlevande liv, som inkluderar många djurarter och alger.
Levande varelser
Människan bildas, cirka 60% av vatten och samtidigt rik på syre. Men dessutom är syre en del av många föreningar, såsom fosfater, karbonater, karboxylsyror, ketoner, etc., som är viktiga för livet.
Syre finns också i polysackarider, lipider, proteiner och nukleinsyror; det vill säga de så kallade biologiska makromolekylerna.
Det är också en del av skadligt slöseri med människans aktivitet, till exempel: koldioxid och dioxid, samt svaveldioxid.
Biologisk produktion
 Växter ansvarar för att berika syreluften i utbyte mot koldioxid som vi andas ut. Källa: Pexels.
Växter ansvarar för att berika syreluften i utbyte mot koldioxid som vi andas ut. Källa: Pexels. Syre inträffar under fotosyntes, en process genom vilken marin fytoplankton och markväxter använder ljusenergi för att reagera koldioxid med vatten, vilket orsakar glukos och släpper syre.
Det uppskattas att mer än 55% av syre som produceras genom fotosyntes beror på verkan av den marina fytoplankton. Därför utgör det den huvudsakliga källan till syreproduktion på jorden och ansvarar för att upprätthålla livet i den.
Industriell produktion
Lufttänkande
Den huvudsakliga industriella syreproduktionsmetoden skapas 1895, oberoende av Karl Paul Gottfried von Linde och William Hamson. Denna metod använder för närvarande några modifieringar.
Kan tjäna dig: Butanone: Struktur, egenskaper och användningarProcessen börjar med luftkomprimering för att kondensera vattenånga och eliminerar därmed den. Sedan siktas luften när den genomförs av en blandning av zeolit och kiseldioxidgel, för eliminering av koldioxid, tunga kolväten och resten av vattnet.
Därefter separeras komponenterna i flytande luft genom en fraktionerad destillation, vilket uppnår separationen av gaserna som finns i dess olika kokpunkter. Med denna metod erhålls syre med 99% renhet.
Vattenelektrolys
Syre produceras genom mycket renad vattenelektrolys och med elektrisk konduktivitet som inte överstiger 1 μs/cm. Vatten separeras genom elektrolys i dess komponenter. Väte som katjon flyttar till katoden (-); Medan syre rör sig mot anoden (+).
Elektroderna har en speciell struktur för att samla gaserna och producera därefter sin kondensering.
Termisk nedbrytning
Den termiska nedbrytningen av föreningar såsom kvicksilveroxid och värd (kaliumnitrat) frisätter syre, som kan samlas in för användning. Peroxider används också för detta ändamål.
Biologiskt papper
Syre produceras av fytoplankton och landväxter genom fotosyntes. Den korsar lungväggen och i blodet fångas den av hemoglobin, som transporterar den till olika organ och sedan används i cellmetabolism.
I denna process används syre under metabolismen av kolhydrater, fettsyror och aminosyror för att i slutändan producera koldioxid och energi.
Andning kan schematisera enligt följande:
C6H12ANTINGEN6 + ANTINGEN2 => Co2 + H2Eller +energi
Glukos metaboliseras i en uppsättning sekventiella kemiska processer, som inkluderar glykolys, Krebs -cykeln, den elektroniska transportkedjan och oxidativ fosforylering. Denna serie av händelser producerar energi som ackumuleras som ATP (Adenosín Triposphate).
ATP används i olika processer i celler som inkluderar transport av joner och andra ämnen genom plasmamembranet; tarmsabsorptionen av ämnen; sammandragningen av olika muskelceller; Metabolismen av olika molekyler etc.
Polymorfonukleära och makrofag leukocyter är fagocytiska celler som kan använda syre för att producera superoxidjon, väteperoxid och enstaka syre, som används för att förstöra mikroorganismer.
Risker
Andningssyre till högt tryck kan orsaka illamående, yrsel, muskelspasmer, synförlust, kramper och medvetenhetsförlust. Dessutom orsakar andning rent syre under en lång tid lungirritation, manifesteras av hosta och en förkortning av andningen.
Det kan också vara orsaken till bildandet av ett lungödem: ett mycket allvarligt tillstånd som begränsar andningsfunktionen.
En atmosfär med hög syrekoncentration kan vara farlig, eftersom den underlättar utvecklingen av bränder och explosioner.
Ansökningar
Läkare
Syre administreras till patienter som har andningsfel; Så är fallet med patienter som drabbats av lunginflammation, lungödem eller emfysem. De kunde inte andas miljö syre eftersom de skulle påverkas allvarligt.
Patienter med hjärtsvikt i det som presenteras vätskansamling i alveoler behöver också syre för att levereras; Som patienter som har drabbats av en allvarlig vaskulär olycka (stroke).
Arbetsbehov
Brandmän som kämpar mot en brand i en miljö med olämplig ventilation, kräver användning av masker och syreflaska som gör att de kan uppfylla sina funktioner, utan att sätta sina liv i större risker.
Ubåtar är utrustade med syreproduktionsutrustning som gör det möjligt för sjömän att stanna i en stängd miljö utan atmosfärisk luftåtkomst.
Dykarna gör sitt arbete nedsänkt i vattnet och är därför isolerade från atmosfärisk luft. De andas av syre som pumpas med rör anslutna till deras skanning eller användning av bomboner fästa vid ubåtens kropp.
Astronauter genomför sina aktiviteter i miljöer utrustade med syregeneratorer som tillåter överlevnad under rymdresor och i en rymdstation.
Industriell
Mer än 50% av det industriellt producerade syre konsumeras i omvandlingen av järn till stål. Gjutjärn injiceras med en syrestråle för att eliminera svavel och kol närvarande; reagera på att producera så gaser2 och co2, respektive.
Acetylen används i kombination med syre för att klippa metallplattor och även för att producera dess svetsning. Syre används också i glasproduktion, vilket ökar förbränningen i sin bakning för att förbättra dess transparens.
Atomabsorptionsspektrofotometri
Kombinationen av acetylen och syre används för att bränna prover av olika ursprung i en atomabsorptionsspektrofotometer.
Under proceduren påverkas en ljusstråle från en lampa av lågan, vilket är specifikt för det element som önskas att kvantifiera. Flammen absorberar lampans ljus, vilket tillåter kvantifiering av elementet.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Wikipedia. (2019). Syre. Hämtad från: i.Wikipedia.org
- Richard Van Noordden. (13 september 2006). Bara en vacker fas? Fast rött syre: värdelös men förtjusande. Återhämtad från: naturen.com
- Azonano. (4 december 2006). Fast syre-e-fas kristallstruptur bestämd längs upptäckten av ett syre O8-kluster. Återhämtat sig från: Azonano.com
- Nationellt centrum för bioteknikinformation. (2019). Syremolekyl. Pubchemdatabas. CID = 977. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Doktor. Doug Stewart. (2019). Syreelementfakta. Kemikkolis. Återhämtat sig från: Chemicool.com
- Robert C. Hårbåt. (9 juli 2019). Syre: Kemiskt element. Encyclopædia Britannica. Återhämtat sig från: Britannica.com
- Wiki barn. (2019). Syrefamilj: Egenskaper för Via Elements. Återhämtad från: helt enkelt.Vetenskap
- AVAMEG, INC. (2019). Syre. Återhämtat sig från: Madehow.com
- Lentech B.V. (2019). Period Tabell: syre. Återhämtat sig från: Lentech.com
- New Jersey Department of Health and Senior Services. (2007). Syre: Faktablad för farligt ämne. [Pdf]. Återhämtat sig från: nj.Gov
- Yamel Mattarollo. (26 augusti 2015). Industriella syre industriella tillämpningar. Återhämtat sig från: altecdust.com
- « Neonhistoria, egenskaper, struktur, risker, användningar
- Histidinegenskaper, struktur, funktioner, mat »

