Histidinegenskaper, struktur, funktioner, mat
- 2208
- 168
- Lars Eriksson
De Histidin (Hans, h) Det är en aminosyra som används för proteinsyntes. Det är en hydrofil molekyl, så den är generellt inriktad på utsidan av proteinstrukturer när de är i ett flytande medium.
Det anses vara en viktig aminosyra för växande barn eftersom de inte producerar den. Hos vuxen finns en liten histidinproduktion, men det är otillräckligt att tillgodose de dagliga kraven så att det betraktas som en seminosyra som är en seminosyra.
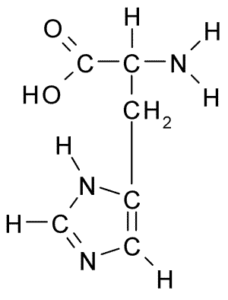 Kemisk struktur av histidinaminosyran (källa: Borb, via Wikimedia Commons)
Kemisk struktur av histidinaminosyran (källa: Borb, via Wikimedia Commons) För djur och människa är histidin en väsentlig eller åtminstone seminisk aminosyra, växter, svampar och mikroorganismer producerar emellertid effektivt histidin de behöver och ingår i dietkällorna till histidin, utöver proteiner djur.
Histidin uppfyller mycket viktiga fysiologiska funktioner hos människan, till exempel: de som är en del av de aktiva centra för många enzymer, deltar i tillväxt, i immunsystemet och i bildandet av myelin i nervfibrer, bland andra.
Histidinbiosyntes är en komplex process som huvudsakligen sker i levern och kräver 9 till 11 enzymatiska steg. Dess nedbrytning sker i levern och huden och går igenom bildandet av glutamat och följer sedan olika vägar.
Många livsmedel är rika på histidin, såsom animaliska proteiner som kött och mejeriprodukter, samt växtproteiner. Dessa ger mycket av de dagliga histidinkraven som vår kropp behöver fungera ordentligt.
Underskottet eller överskottet av histidin orsakat av ärvning av metaboliska eller transportproblem, eller kostfel i intag är relaterade till några viktiga problem som påverkar hälsan både hos barn och vuxna. Tillräcklig histidinförbrukning gör att du kan upprätthålla ett hälsosamt och hälsosamt liv i de flesta fall.
[TOC]
Egenskaper
En markeringskaraktäristik för histidin är att det kan omvandlas till histamin, ett ämne som aktivt deltar i många allergiska och inflammatoriska reaktioner.
I fisken som utsätts för miljön utan tillräcklig kylning kan bakterier omvandla histidin till histamin och det är därför de, när de intagas, orsakar matförgiftning.
En annan egenskap hos denna aminosyran är att den är en av få, bland de befintliga 22, att inom området fysiologiskt pH (cirka 7.4) Det är joniserat och kan därför aktivt delta i det katalytiska stället för många enzymer.
I hemoglobinmolekylen är proximal histidin en av hemo -gruppens ligander. Med andra ord, denna aminosyran deltar i syretransportfunktionen hos hemoglobin och är nödvändig för syntesen av detta protein, såväl som för myoglobin, som också kallas ”muskelhemoglobin”.
Strukturera
Histidin är en aminosyra Hydrofilisk polär grundläggande, Klassificeras inom essentiella aminosyror, eftersom det inte kan syntetiseras av djur. Men som tidigare nämnts syntetiseras det av bakterier, svampar och växter.
Hos växande barn är histidin absolut nödvändigt; Den vuxna kan syntetisera det, men det är inte klart om detta täcker de dagliga behoven hos histidin, så det måste intas med kosten.
Liksom alla aminosyror har histidin ett a -kol till vilket en aminogrupp, en karboxylgrupp, en väteatom och en sidokedja förenas.
Kan tjäna dig: coxiella burnetiiDen laterala kedjan av denna aminosyran bildas av en imidazolring som, till fysiologiskt pH, protoner och förvärvar positiv belastning och kallas "Imidazolio " förkortat som IMH+.
Tillsammans med lysin och arginin bildar histidin gruppen av grundläggande aminosyror. Av de tre är histidin det minst grundläggande och dess imididoólica -ring kan vara oskyddad till pH nära 6.
Eftersom fysiologiskt pH -histidin kan utbyta protoner deltar detta vanligtvis i enzymatisk katalys som involverar överföring av protoner. Dessutom, eftersom det är en polar aminosyra, finns den vanligtvis på proteins yttre yta, där den kan hydrera i ett vattenhaltigt medium.
Funktioner
Som en del av det aktiva enzymplatsen
Histidin är nödvändig för syntes av många proteiner, särskilt enzymer vars aktiva centra har denna aminosyra. Det är en del av det aktiva mitten av däggdjursaldlasaserna, där det fungerar som protondonator.
Det ligger i det aktiva centrumet av karboxipeptidas A, ett bukspottkörtelenzym som har en aktiv plats bildad av Zn och Histidine. I det glykolitiska enzymet mutasa fosfoglycerat finns det två histidinavfall i dess aktiva centrum som fungerar som acceptorer eller givare av fosforylgrupper.
Det finns också i det aktiva stället för enzymer såsom glyceraldehyd 3-fosfatdehydrogenas, laktatdehydrogenas, papain, chimotripsin, RNASA A och ammoniak-liasa histidin (histidas). Dessutom är det en hämmare av enzymets glutaminsyntetas.
Andra funktioner
Denna aminosyra är av stor betydelse för organismen, eftersom dess decarboxylashistidin Decarn.
Histidin produceras av neuroner i centrala nervsystemet med neuromodulatoriska funktioner.
Det är nödvändigt för bildandet av myelinbockor av nervfibrer, så det möter en viktig roll i överföringen av elektriska impulser i dem.
Tillsammans med tillväxthormon och andra aminosyror bidrar histidin till vävnadsreparationsmekanismer, främst i det hjärt -kärlsystemet.
Vissa ytterligare funktioner inkluderar:
- Bidrar med avgiftning av vissa tungmetaller eftersom det fungerar som att kelera.
- Skyddar mot skador orsakade av strålning.
- Delta i bildandet av röda och vita blodkroppar.
- Det är nödvändigt för hemoglobinbildning.
- Det hjälper till att bekämpa några negativa effekter av reumatoid artrit såsom inflammation och brist på rörlighet.
- Det är en viktig aminosyra för kapillärförnyelse, tillväxt och sexuell funktion.
Carnosine, anserin och homocosin, är dipéptider bildade av histidin. De två första finns i musklerna och har viktiga funktioner som tamponger och som aktivatorer av myosin atasa.
Homokosin produceras i hjärnan i mängder 100 gånger högre än skelettmuskeln köttig.
Biosyntes
Histidin erhåller sitt kolsyrat skelett från 5-fosfatribosen. I bakterierna OCH. Coli, Denna aminosyra inträffar från nämnda förening med hjälp av 11 enzymatiska steg:
- Det första steget i syntesen består i överföringen av en fosforbosyl från ATP till kol 1 i 5-fosfatribosen, vilket genererar 5-fosforborribosyl-1-pyrofosfat (PRPP) (PRPP). Fosforbosyl-pyrofosfatsyntetas (PrPP-syntetas) enzym katalyserar denna reaktion.
- Sedan inträffar överföringen av kolpyrofosfatgruppen 1 till N-1 för ATP, och N1- inträffar (5'-fosforribosyl) -atp. Enzymet som katalyserar denna reaktion är ATP -fosforeltransferas.
- Genom verkan av fosforribosyl-top-pyrofosfathydroxylas är a, p-pyofosfatlänken för ATP hydroxilas och N1- bildas (5'-fosforborribosyl) -Amp.
- Fosforibosyl-map-enzymet hydroxylas öppnar purinringen mellan N-1 och C-6 och ribonukleotiden bildas N1- (5'-fosforbosil formimino) -5-aminoimidazol-4-karboxamid-1-lribonukleotid.
- Sedan öppnas ribofuranosa-ringen som kommer från PRPP och isomeriseras till en ketosa, som bildar N1- (5'-fosforibosylformimin) -5-aminoimidazol-4-karboxamid-1-lribonukleotid med effekt av ett isomeras-enzyme.
- Aminotransferasenzymet överför den bland gruppen av glutamin, som blir glutamat och bryter formiminlänken, så det frigörs 5-aminoimidazol-karboxamid-1-lribonukleotid och imidazol-glycerolfosfat genereras genereras.
- En vattenmolekyl av imidazol-glycerolfosfat elimineras med hjälp av imidazol-glycerolfosfatdehydrataset och bildar imidazol-acetolfosfat.
- Imidazol-acetolfosfat överförs en aminogrupp genom histidinoltransaminasfosfat och fosfathistidinolen bildas.
- Den fosforiska estergruppen av histidinolfosfat för att bilda histidinol är hydrolyserad. Histidinolfosfatfospatas katalyserar denna reaktion.
- Senare oxideras histidinol genom histidinoldehydrogenas och är histidinal.
- Samma histidinoldehydrogenas oxiderar till histidinal och gör det histidin.
Det första enzymet av den biosyntetiska vägen för histidin hämmas av produkten från rutten, det vill säga att histidinet deltar i den alestriska hämningen av ATP -fosforribosyltransferas, som representerar huvudmekanismen för reglering av rutten av rutten av rutten.
Degradering
Histidin, prolin, glutamat, arginin och glutamin är aminosyror som när de slutar bilda a-zotoglurat. Fyra av dem blir först glutamat, som på grund av transaminering ger upphov till a-ketoglutorat.
Histidin, genom histidinas, förlorar a-amino-gruppen för att bli urocanato. Sedan fuktar urokanaset positionerna 1 och 4 i urokanato och bildar 4-midazolon-5-propionat. Därefter inträffar imino-gruppen av 4-midazolon-5-propionato, och bildar n-formiminoglutamato.
Den sista reaktionen innebär överföring av formylen från N-formiminoglutamatet till tetrahydrofolat, som fungerar med enzymglutamatformiminös överföring. De slutliga produkterna från denna reaktion är glutamat och N5-formimino-tetrahydrofolat.
A-ketoglutarat bildas genom glutamattransaminering. A-ketoglutarat är en mellanhand av Krebs-cykeln och kan också komma in i den glukoneogena vägen för glukosbildning.
Glutamato -aminogruppen kommer in i ureaproduktionscykeln som ska elimineras med urin. Alla dessa reaktioner förekommer i levern och en del av dem på huden.
Livsmedel rika på histidin
De dagliga histidinbehoven är cirka 10 till 11 mg per kg kroppsvikt per dag. Hos växande barn är histidin en essentiell aminosyra som måste levereras med kosten.
Hos andra djur är histidin också en essentiell aminosyra och de som är uppfödda i stall bör få histidin för att bibehålla sina normala hemoglobinnivåer.
Bland de livsmedel som är rika på histidin är:
- Nötkött, lamm, fläsk, kyckling och kalkon. Det finns också i fisk som tonfisk (även i konserverad), lax, öring, pargo och lubina, samt i någon skaldjur.
Kan tjäna dig: blodkultur: vad är det för, grund, procedur, resultat- Mjölk och dess derivat, särskilt i mogna ostar som Parmesan, Gruyere, Swiss Cheese, Gouda, bland andra. I de infödda, i serumet, i yoghurten och i gräddfilen.
- Sojabönor och nötter som nötter och frön. I solros, pumpa, vattenmelon, sesam, mandlar, pistasch, jordnötssmör och chia.
- Ägg och bönor eller vita bönor.
- Helkorn som quinoa, vete, integrerat ris, etc.
Fördelar med ditt intag
Det finns ett antal patologiska tillstånd där histidin kan vara användbara som adjuvans för behandling.
Bland dessa patologier kan vi namnge reumatoid artrit, arteriell hypertoni (eftersom en hypotensiv effekt av histidin har beskrivits), i infektioner, frigiditet och kön och hörsel, sår och anemias.
I huden producerar nedbrytningen av histidin -konsumerade urokansyra, som kan skydda huden eftersom den absorberar ultravioletta strålar.
Överskottskonsumtion av friska individer ger inte stora förändringar, eftersom det snabbt försämras. Användningen av histidintosttillskott hos de patienter med allvarliga lever- och/eller njurproblem bör dock begränsas.
Brist
Histidinunderskottet är relaterat till förändringar i immunsvaret.
Benproblem, dövhet och anemier associerade med histidinunderskott har också rapporterats.
Hartnups sjukdom är ett ärftligt tillstånd som påverkar transport av histidin och tryptofan genom slemhinnan i det tunna tarmen och njurarna, vilket orsakar ett underskott av båda aminosyrorna.
De mest relevanta kliniska manifestationerna är utseendet på Schegous och röda skador i huden efter exponering för solen, olika grader av rörelseförändring och vissa symtom på psykiatriska sjukdomar.
Histidinemi är en autosomisk recessiv sjukdom som kännetecknas av underskottet av histidasenzymet, vilket orsakar en ökning av koncentrationerna av histidin i blod och urin.
Som en följd av detta kan dessa patienter inte försämra histidin till urocal syra i levern och huden. Denna sjukdom åtföljs av måttlig mental retardering, talfel och hörselminne utan dövhet.
Begränsningen av histidinintag som behandling har inte varit effektiv för att generera klinisk förbättring och innebär risken för att generera tillväxtstörningar hos barn som drabbats av denna sjukdom.
Referenser
- Mathews, C., Van Holde, K., & Ahern, K. (2000). Biokemi (3: e upplagan.). San Francisco, Kalifornien: Pearson.
- Murray, r., Bender, D., Botham, K., Kennelly, s., Rodwell, V., & Weil, s. (2009). Harpers illustrerade biokemi (28: e upplagan.). McGraw-Hill Medical.
- Nelson, D. L., & Cox, M. M. (2009). Lehninger principer för biokemi. Omega -utgåvor (5: e upplagan.). doi.org
- Perecarz, s., Farri, l., & Papageorgiou, a. (1983). Effekterna av bröstmjölk och lågproteinformler på hastigheterna för total kroppsproteinskift och urin 3-metylhistidin utsöndring av för tidigt spädbarn. Klinisk vetenskap, 64, 611-616.
- Sång, b. C., Joo, n., Aldini, g., & Yeum, K. (2014). Biologisk funktion av histidindipeptider och metaboliskt syndrom. Näringsforskning och praktik, 8(1), 3-10.
- « Syreegenskaper, struktur, risker, användningar
- Expertssystem historia, egenskaper, fördelar, nackdelar »

