OxidorReductases Egenskaper, struktur, funktioner, exempel
- 2561
- 770
- Karl Johansson
De oxidorreduktaser De är protein med enzymatisk aktivitet som ansvarar för katalyserande reaktioner av rostreduktion, det vill säga reaktioner som innebär avlägsnande av väte eller elektronatomer i de underlag som de verkar.
De reaktioner som katalyseras av dessa enzymer, som namnet antyder, är oxidreduktionsreaktioner, det vill säga reaktioner där en molekyl donerar elektroner eller väteatomer och en annan tar emot dem, ändrar deras respektive oxidationstillstånd.
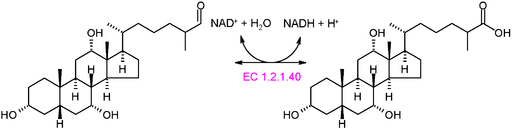 Grafiskt schema för reaktionen av ett oxidortas av typ EC 1.2.1.40 (Källa: Akane700 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] via Wikimedia Commons)
Grafiskt schema för reaktionen av ett oxidortas av typ EC 1.2.1.40 (Källa: Akane700 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] via Wikimedia Commons) Exempel på mycket vanliga oxidortiska enzymer i naturen är dehydrogenaser och oxidaser. Det kan nämnas för enzymet av alkoholdehydrogenas, som katalyserar dehydrogeneringen av etanol för att producera acetaldehyd i en NAD+ beroende eller omvänd reaktion, för att producera etanol under alkoholhalten som utförs av några kommersiellt viktiga yests.
Enzymerna i elektrontransportörskedjan i de aeroba cellerna är oxidortas som ansvarar för pumpning av protoner, så de genererar den elektrokemiska gradienten genom det inre mitokondriella membranet som gör det möjligt att öka syntesen av ATP.
[TOC]
Generella egenskaper
Oxidoreduktasenzymer är enzymer som katalyserar oxidationen av en förening och samtidig reduktion av en annan.
Dessa kräver normalt förekomsten av olika typer av koenzymer för deras operation. Koenzymer uppfyller funktionen att donera eller acceptera.
Dessa koenzymer kan vara NAD+/NADH Torus eller FAD/FADH2 -vridmomentet. I många aeroba metaboliska system överförs dessa elektroner och väteatomer så småningom från de involverade koenzymerna till syre.
De är enzymer med en uttalad "brist" på substratspecificitet, vilket gör att de kan katalysera tvär -risreaktioner i olika typer av polymerer, oavsett om det är protein eller kolhydrater.
Klassificering
Många gånger är nomenklaturen och klassificeringen av dessa enzymer baserad på både det huvudsakliga underlaget de använder och vilken typ av koenzym de behöver för att fungera.
Enligt rekommendationerna från Nomenclature Committee of the International Union for Biochemistry and Molecular Biology (NC-IBMB) tillhör dessa enzymer klass E.C. 1 och inkludera mer eller mindre 23 olika typer (e.C.1.1-e.C.1.23), som är:
Kan tjäna dig: Erytropoietin (EPO): Egenskaper, produktion, funktioner- OCH.C. 1.1: som agerar i CH-OH-grupperna av givare.
- OCH.C. 1.2: Vilken agerar i Aldehyd -gruppen eller Oxo de Los Donor Group.
- OCH.C. 1.3: som agerar i ch-ch-grupperna av givare.
- OCH.C. 1.4: som agerar i CH-NH2-grupperna av givare.
- OCH.C. 1.5: som agerar i CH-NH-grupperna av givare.
- OCH.C. 1.6: Vilket agerar i NADH eller NADPH.
- OCH.C. 1.7: som verkar på andra kväveföreningar som givare.
- OCH.C. 1.8: som agerar på svavelgrupperna av givare.
- OCH.C. 1.9: som agerar i hemo -grupperna av givare.
- OCH.C. 1.10: som agerar i givare som difenoles och andra relaterade ämnen.
- OCH.C. 1.11: som verkar på peroxid som en acceptor.
- OCH.C. 1.12: som verkar på väte som givare.
- OCH.C. 1.13: som verkar på enkla givare med införlivande av molekylär syre (syresättningar).
- OCH.C. 1.14: som verkar på "parade" givare, med införlivande eller reduktion av molekylärt syre.
- OCH.C. 1.15: som verkar på superoxider som acceptorer.
- OCH.C. 1.16: vilka oxiderar metalljoner.
- OCH.C. 1.17: som agerar på CH2 -grupper.
- OCH.C. 1.18: som verkar på proteiner som innehåller järn och antar som givare.
- OCH.C. 1.19: som verkar på reducerat flavodoxin som givare.
- OCH.C. 1.20: som verkar på givare som fosfor och arsenik.
- OCH.C. 1.21: som verkar i reaktionen x-h + y-h = x-y.
- OCH.C. 1.22: som verkar på givarnas halogen.
- OCH.C. 1.23: som minskar C-O-C-grupper som acceptorer.
- OCH.C. 1.97: Andra oxidoryduktaser.
Var och en av dessa kategorier inkluderar också undergrupper där enzymer separeras enligt preferensen för substrat.
Kan tjäna dig: primär succession: egenskaper och exempelTill exempel, inom gruppen av oxidoreduktaser som verkar på CH-OH-grupperna för deras givare finns det några som föredrar NAD+ eller NADP+ som acceptorer, medan andra använder cytokromer, syre, svavel, etc.
Strukturera
Eftersom gruppen av oxidoreduktaser är extremt mångfaldig, är det ganska komplicerat att etablera en definierad strukturell egenskap. Dess struktur varierar inte bara från enzym till enzym, utan också mellan arter eller grupp levande varelser och till och med cell till cell i olika vävnader.
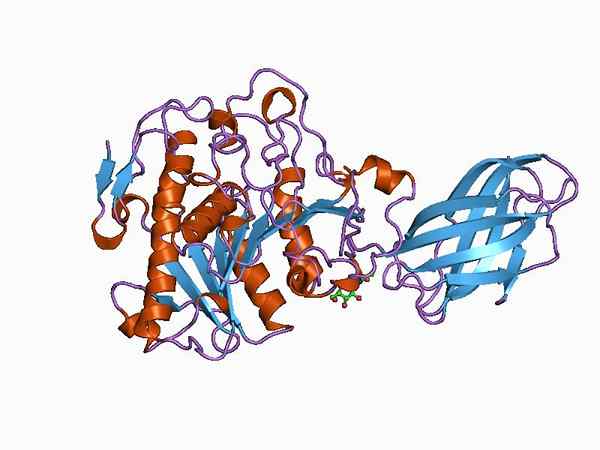
 Bioinformatikmodell av strukturen för ett oxyduktasenzym (källa: Jawahar Swaminathan och MSD -personal vid European Bioinformatics Institute [Public Domain] via Wikimedia Commons)
Bioinformatikmodell av strukturen för ett oxyduktasenzym (källa: Jawahar Swaminathan och MSD -personal vid European Bioinformatics Institute [Public Domain] via Wikimedia Commons) The enzyme pyruvate dehydrogenase, for example, is a complex composed of three sequentially linked catalytic subunits and known as the E1 subunit (dehydrogenase piruvate), the E2 subunit (dihydrolipamide acetyltransferase) and the E3 subunit (dihydrolipamide dehydrogenase).
Var och en av dessa underenheter kan i sin tur bestå av mer än en proteinmonomer av samma typ eller av olika typer, det vill säga de kan vara homodimeriska (de med bara två lika monomerer), heterotrimérica (som har tre monomerer olika) och så vidare.
Det är emellertid vanligtvis enzymer som består av alfa-hallar och p-pläterade ark arrangerade i olika former, med specifika intermolekylära interaktioner av olika typer av olika typer.
Funktioner
Oxidorterade enzymer katalyserar oxidreduktionsreaktioner praktiskt taget i alla celler i alla levande varelser på biosfären. Dessa reaktioner är i allmänhet reversibla, där oxidationstillståndet för en eller flera atomer inom samma molekyl förändras.
Vanligtvis behöver oxidorestonerna två underlag, en som fungerar som en givare av väte eller elektroner (som oxiderar) och en annan som fungerar som en acceptor av väte eller elektroner (vilket reduceras).
Dessa enzymer är oerhört viktiga för många biologiska processer i olika typer av celler och organismer.
De arbetar till exempel i syntesen av melanin (ett pigment som bildas i cellerna i huden hos människor), vid bildning och nedbrytning av lignin (strukturell förening av växtceller), i vikning av proteiner, etc.
Det kan tjäna dig: arter introducerade på GalapagosöarnaDe används industriellt för att modifiera strukturen på vissa livsmedel och exempel på dessa är peroxidaser, oxidasglukos och andra.
Dessutom är de mest framträdande enzymerna i denna grupp de som deltar som elektroniska transportörer i transportkedjorna i mitokondriella membranet, kloroplaster och inre plasmamembran av bakterier, där de är transmembranala proteiner.
Exempel på oxidortas
Det finns hundratals exempel på oxiderade enzymer i naturen och industrin. Dessa enzymer har, som nämnts, funktioner av yttersta vikt för cellulär funktion och därför för livet i sig.
Oxidiductaser inkluderar inte bara peroxidasenzymer, lack, oxidasglukos eller dehydrogen alkohol; De kombinerar också viktiga komplex såsom glyceraldehydenzymet 3-fosfatdehydrogenas eller kompimenusdehydrogenas, etc., väsentligt ur glukoskatabolism.
Det inkluderar också alla enzymer i det elektroniska transportkomplexet i det inre mitokondriella membranet eller i det inre membranet av bakterier, liknande några av de enzymer som finns i kloroplasterna av växtorganismer.
Peroxidaser
Peroxidaser är mycket olika enzymer och använder väteperoxid som elektronacceptor för att katalysera oxidation av olika substrat, inklusive fenoler, aminer eller tioler, bland andra. I dess reaktioner minskar de väteperoxid tills den producerar vatten.
De är mycket viktiga ur den industriella synvinkeln och är peroxidaset för den kryddig rädisor de viktigaste och de mest studerade av alla.
Biologiskt sett är peroxidaser viktiga för eliminering av reagens syreföreningar som kan orsaka betydande skador på cellerna.
Referenser
- Britannica Encyclopaedia. (2019). Hämtad 26 december 2019 från www.Brittisk.com
- Ercili-cura, d., Hupperz, t., & Kelly, a. L. (2015). Enzymatisk modifiering av mejeriproduktstruktur. Vid modifiering av matstrukturen (pp. 71-97). Woodhead Publishing.
- Mathews, C. K., Van Holde, K. OCH., & Ahern, K. G. (2000). Biokemi. LÄGG TILL. Wesley Longman, San Francisco.
- Nelson, D. L., Lehninger, a. L., & Cox, M. M. (2008). Lehninger principer för biokemi. Macmillan.
- Nomenklaturkommittén för International Union of Biochemistry and Molecular Biology (NC-IBMB). (2019). Hämtad från www.Qmul.Växelström.Storbritannien/SBCS/IUBMB/enzym/index.Html
- Patel, m. S., Nemeria, n. S., Furey, w., & Jordan, f. (2014). Pyruvat dehydrogenaskomplex: strukturbasfunktion och reglering. Journal of Biologic Chemistry, 289 (24), 16615-16623.

