Pencanona kemisk struktur, egenskaper, syntes, användningar
- 2012
- 372
- Anders Larsson
De Pentanona Det är en organisk förening som tillhör ketonernas familj, vars kemiska formel är c5H10ANTINGEN. Det är fortfarande en av de enklaste ketoner och består av en färglös vätska med en arom som liknar den för aceton. Från det från och med nu, med avseende på kolnumret på deras skelett, ketonerna presenterar position isomer.
När man talar om position hänvisar isomeria till var karbonylgruppen är, c = o. Således består Puntanona faktiskt av två föreningar med fysiska egenskaper som knappt skiljer sig från varandra: 2-penon och 3-penon (lägre bild). Båda är flytande, men deras kokpunkter är desamma, så de kan inte separeras genom destillation.
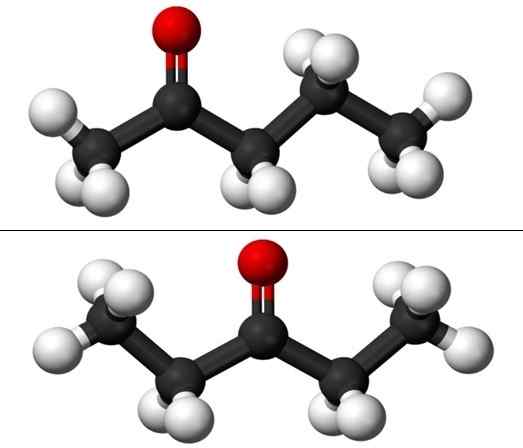
 Molekyler av positionsisomererna för Pentanona. Källa: Jynto & Ben Mills via Wikipedia.
Molekyler av positionsisomererna för Pentanona. Källa: Jynto & Ben Mills via Wikipedia. Men var och en av de två pentanonerna har sin egen syntesväg, så det är osannolikt att det finns en blandning av dem; blandning som kan vara möjlig att separera genom frysning.
Användningen är begränsade särskilt som organiska lösningsmedel; Alternativ till aceton i media där du arbetar med en temperatur högre än dess låga kokpunkt. De är också startmaterial för annan organisk syntes, eftersom deras grupp C = O kan minska eller drabbas av nukleofilt tillägg.
[TOC]
Kemisk struktur
Positionsisomerer
På bilden har vi molekylstrukturerna i de två positionsisomererna för Puntanona, representerade av en modell av sfärer och staplar. De svarta sfärerna motsvarar kolsyrade skelett, vita till väteatomer och röda syreatomer i grupp C = O.
2-pintanon
2-Ponanona (ovan) har grupp C = eller i det andra kolet, vilket motsvarar om det var i rummet; Det vill säga 2-Ponanona och 4-Pantanona är likvärdiga, eftersom det räcker för att rotera dem 180º så att deras strukturer är desamma.
Kan tjäna dig: koltetraklorid (CCL4)Till vänster om C = O har du en metylradikal, Cho3-, Och till höger, ett radikalt företag. Det är därför denna Cetona också får namnet (mindre använt) från Metil -propil Cetona (MPK på engelska). Du kan se asymmetrin för denna struktur vid första anblicken.
3-kön
3-péntanona (nedan) har grupp C = O i det tredje kolet. Observera att denna isomer är en större version av aceton, och att den också är mycket symmetrisk; De två radikalerna på sidorna av grupp C = O är desamma: två etylradikaler, Ch3Ch2-. Det är därför 3-Pananona också kallas Cetona Diestil (eller dimetylaceton).
Intermolekylär interaktioner
Närvaron av karbonylgruppen, både i 2-pantanonet och i 3-Penona, ger molekylens polaritet.
Därför kan båda Pentanona-isomererna interagera med varandra genom dipol-dipol.
På samma sätt ingriper London -spridningskrafter mellan kol och hydrerade skelett i mindre utsträckning.
Genom att ha Puntanona, ett större molekylområde och massa jämfört med acetonen, lägger detta bidrag till dess dipolmoment och möjliggör en högre kokpunkt (102 ºC> 56 ºC) för att ha en högre kokpunkt). I själva verket förångas de två isomererna vid 102 ºC; Medan de fryser vid olika temperaturer.
Kristaller
Förmodligen i kristallisation spelar symmetrierna en viktig roll. Till exempel är fusionspunkten för 2 -pantanona -78 ºC, medan 3 -péntanona, -39 ºC.
Kan tjäna dig: Avogadro LawDetta innebär att 3-Pantanona-kristaller är mer stabila mot temperaturen; Dess molekyler är mer sammanhängande och kräver mer värme för att separera i vätskefasen.
Om det fanns en blandning av båda isomererna, skulle 3-penonen vara den första som kristalliseras, äntligen var 2-Pananona vid en lägre temperatur. Molekylerna i 3-pantanonet, mer symmetriska, är orienterade lättare än för 2-ponanona: asymmetrisk och samtidigt mer dynamisk.
Egenskaper
Fysiskt utseende
Färglösa vätskor med en arom som liknar aceton.
Molmassa
86,13 g/mol
Densitet
0,81 g/ml (3-Ponanona)
0,809 g/ml (2-Ponanona)
Smältpunkt
-78 ºC (2-Ponanona)
-39 ºC (3-Ponanona)
Kokpunkt
102 ºC (för båda isomererna)
Vattenlöslighet
35 g/L (3-Ponenona)
60 g/L (2-Ponenona)
Ångtryck
35 mmHg (3-Ponenona)
270 mmHg (2-pantanon) vid 20 ºC
Dessa värden är inte användbara för att direkt jämföra ångtrycket för båda isomererna, eftersom de första rapporteras utan temperaturen vid vilken den mättes.
Flashpoint
12,78 ºC (3-Ponanona)
10 ºC (2-Ponanona)
Stabilitet
De två Pentanona -isomererna är extremt brandfarliga, så de måste förbli så långt borta från alla värmekällor. Flashpunkter indikerar att en låga kan ställa in ångorna hos båda pentanorna även vid en temperatur av 10 ºC.
Syntes
Även om de två Pentanona -isomererna är fysiskt och kemiskt mycket lika, är deras syntetiska rutter oberoende av den andra, så det är osannolikt att båda erhålls i samma syntes.
2-pintanon
Från och med 2-penolreagenset, en sekundär alkohol, kan detta oxideras till 2-ponanon med hjälp av hypoklorsyra som bildas in situ, HCLO, som ett oxidationsmedel. Oxidation skulle vara:
Det kan tjäna dig: inga elektrolyter: egenskaper och exempel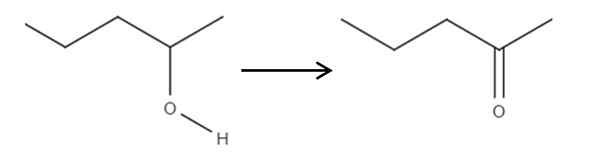 Oxidation av 2-pantanol vid 2-Pantanona. Källa: Gabriel Bolívar.
Oxidation av 2-pantanol vid 2-Pantanona. Källa: Gabriel Bolívar. Helt enkelt blir C-OH-länken C = O. Det finns andra metoder för att syntetisera 2-Penona, men detta är det enklaste att förstå.
3-kön
3-pintanonet kan syntetiseras med medel3Ch2Cooh. Denna syntetiska väg producerar symmetriska ketoner och är att en Cho -molekyl3COOH kommer att förlora COOH -gruppen i form av CO2, Medan den andra din grupp oh i form av h2ANTINGEN:
2ch3Ch2COOH => CH3Ch2Spetsa2Ch3 + Co2 + H2ANTINGEN
En annan lite mer komplex väg är att direkt reagera en blandning av eten, Cho2= Ch2, Co2 och h2 För att bilda 3-ponanona.
Ansökningar
Såvida inte applikationen är mycket rigorös är det en specifik syntes, eller att det också har visats att de två isomererna inte orsakar samma resultat, är det irrelevant att välja mellan att använda 2-penonen eller 3-penonen i någon av dess användning.
Det vill säga "Det spelar ingen roll" om du vill använda 2-Ponanona eller 3-Penona som ett lösningsmedel av målningar eller hartser, eller som en eländig, eftersom de viktigaste kriterierna kommer att bli dess pris och tillgänglighet. 3-penonen används i bilindustrin för att studera beteendet hos gaser i förbränningsmotorer.
Referenser
- Morrison, r. T. och Boyd, R, N. (1987). Organisk kemi. Femte upplagan. Redaktör Addison-Wesley Inter-American.
- Carey f. (2008). Organisk kemi. (Sjätte upplagan). MC Graw Hill.
- Graham solomons t.W., Craig b. Fryhle. (2011). Organisk kemi. Aminer. (10: e upplagan.). Wiley Plus.
- Wikipedia. (2019). 3-smör. Hämtad från: i.Wikipedia.org
- Nationellt centrum för bioteknikinformation. (2019). 2-pontenon. Pubchemdatabas. CID = 7895. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Royal Society of Chemistry. (2019). 3-smör. Återhämtat sig från: chemspider.com
- Professor T. Nalli. (2013). Oxidation av 2-pintanol och destillation av produkten. Återhämtat sig från: kurs1.Winona.Edu

