Adiabatiska processtyper, exempel, övningar löst
- 2817
- 653
- Johan Eriksson
En Adiabatisk process Det är den där det inte finns någon värmeväxling mellan systemet och dess omgivningar, antingen för att det förekommer inom ett isolerande medium, eller för att det passerar mycket snabbt. Detta innebär att i systemets omgivningar är detta, den del av universum som studeras bör temperaturförändringar inte uppfattas, utan bara fungera.
Detta är en av de elementära processerna för termodynamik. Till skillnad från de andra processerna (isokoriska, isobariska och isotermiska) förblir ingen av dess fysiska variabler konstant; Det vill säga storleken på tryck, volym, temperatur och entropi förändras när den adiabatiska processen utvecklas.
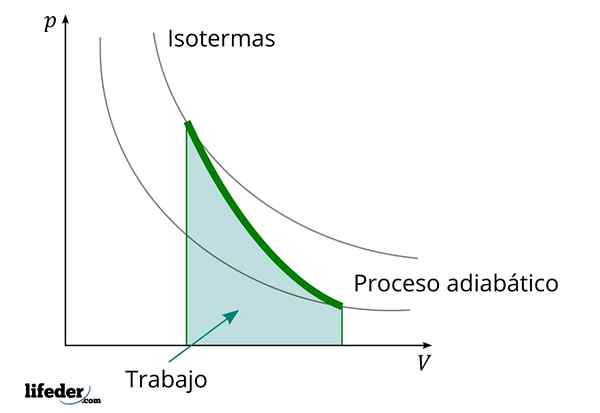
 Under en adiabatisk process där volymen ökar, den inre energin i ämnet som arbetet minskar
Under en adiabatisk process där volymen ökar, den inre energin i ämnet som arbetet minskar En annan viktig egenskap hos de adiabatiska processerna är att de utför eller konsumerar arbetet proportionellt till variationen i deras inre energi; I detta fall av dess molekyler i en gasfas. Detta kan demonstreras tack vare den första lagen om termodynamik.
I det dagliga livet täcker denna typ av process framför allt geofysiska fenomen och, till viss del, fungerar kolvarna i dieselmotorerna. Värmeöverföring förhindras ofta med användning av ett isolerande medium, men det är hastigheten på dessa processer som möjliggör deras verkliga utveckling.
[TOC]
Reversibla och irreversibla adiabatiska processer
Reversibel
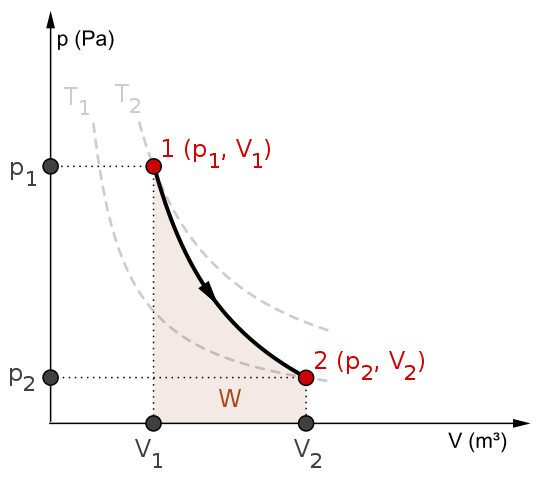 P-V-diagram och arbete W för en adiabatisk process. Källa: Mikerun/CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/4.0)
P-V-diagram och arbete W för en adiabatisk process. Källa: Mikerun/CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/4.0) Adiabatiska processer kan vara reversibla eller irreversibla. Den förstnämnda finns emellertid endast som teoretiska verktyg för att studera det senare. Således involverar de reversibla adiabatiska processerna de ideala gaserna och saknar friktion och någon annan händelse som orsakar en värmeöverföring mellan systemet och dess omgivningar.
Tänk till exempel på P-V-diagrammet för den reversibla adiabatiska processen ovanifrån. T1 och t2 motsvarar två isotermer, på vilka trycket P och volymerna V av systemet varierar.
Bland staterna (s1, V1) Och P2, V2) En reversibel adiabatisk expansion utförs, eftersom vi flyttar från en volym V1 till en V2, större, efter pilens riktning.
På så sätt svalnar systemet, men utan att följa isotermernas beteende. Området under kurvan motsvarar Work W, vars värde är positivt eftersom det är en expansion.
I denna process förblir entropin konstant och därför sägs det att den är isontropisk. Den matematiska bearbetningen av denna reversibilitet genererar en uppsättning ekvationer som det är möjligt att utvärdera andra system.
Kan tjäna dig: elektrolytiska cellerIrreversibel
Irreversibla adiabatiska processer, till skillnad från de reversibla, är inte grafiska i P-V-diagrammen med kontinuerliga men prickade linjer, eftersom endast de slutliga och initiala tillstånden har sina variabler (P, V och T) väl definierade. Dessa processer involverar verkliga gaser, så ekvationen av idealiska gaser och deras härledningar är inte direkt tillämpliga på dem.
De passerar snabbt och förhindrar värmeöverföring mellan systemet och dess omgivningar. I dem ökar också entropin, som anges i den andra lagen om termodynamik.
Exempel på adiabatiska processer
 Den isolerande kapaciteten, såsom den som presenteras av Thermos, är en av de viktigaste faktorerna för en process för att utveckla adiabatiskt
Den isolerande kapaciteten, såsom den som presenteras av Thermos, är en av de viktigaste faktorerna för en process för att utveckla adiabatiskt Några exempel på adiabatiska processer kommer att nämnas nedan.
Expansion och förståelse
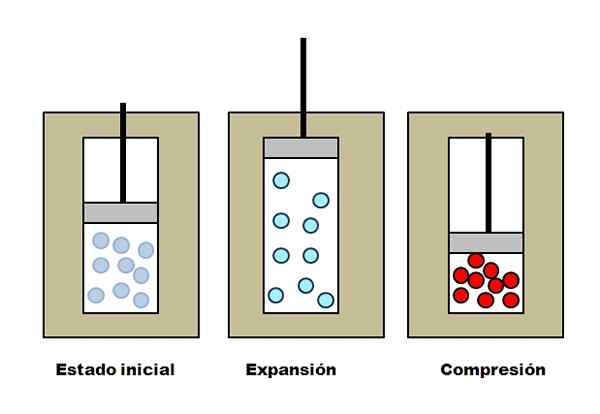 Adiabatisk expansion och förståelse. Källa: Gabriel Bolívar.
Adiabatisk expansion och förståelse. Källa: Gabriel Bolívar. Anta att tre isolerande västar som innehåller fack fulla med gas. I ett initialt tillstånd har kolven inget tryck på gas. Sedan får kolven stiga, vilket ökar volymen genom vilken gasmolekylerna kan röra sig, vilket orsakar en minskning av dess inre energi; Och därför en minskning av temperaturen.
Det motsatta händer med adiabatisk komprimering: kolven utför arbete med gas, vilket minskar volymen som dess molekyler kan uppta. Intern energi ökar denna gång, vilket också innebär en temperaturökning, vars värme inte kan spridas mot omgivningen på grund av den isolerande västen.
Magma Ascent
Kanalerna där magma stiger in i en vulkan berättar som ett isolerande medium, vilket förhindrar värmeöverföring mellan magma och atmosfär.
Ljudspread
Gaserna störs och utvidgas enligt ljudvågen utan att kyla eller varm luften som omger dem.
Foehneffekt
Foehn -effekten är ett exempel på adiabatiska processer inom geofysikområdet. Luftmassorna stiger upp mot den övre delen av ett berg där de upplever mindre tryck, så att deras molekyler expanderar och sval, vilket ger upphov till bildandet av molnet.
Men de sjunker knappt på andra sidan berget, trycket ökar och därför komprimeras molekylerna och höjer sin temperatur, vilket får molnet att försvinna.
Kan tjäna dig: klorbensen (C6H5Cl)I följande video kan detta fenomen uppskattas:
Löst övningar
Slutligen kommer ett par övningar att lösas. Det är viktigt att ha följande ekvationer till hands:
ΔU = Q - W (första lagen om termodynamik)
Men med ingen värmeöverföring, q = 0 y:
ΔU = - W (1)
Detta är: om Work W är positivt är ΔU negativt och vice versa. Å andra sidan har vi också:
W = -nCVΔT (2)
Att efter applicering av den ideala gasekvationen (PV = nRt), och ersätter och löser för T2 och t1 vi kommer att ha:
W = (cV/R) (p1V1 - P2V2) (3)
Att vara värdet på r lika med 0.082 l · atm/mol · k eller 8.314 j/mol · k
I adiabatiska processer är det viktigt att känna till C -förhållandetP/CV känd som y:
y = cP/CV (4)
Som tillåter etablering av T-V och P-V-relationer:
T1V1γ-1 = T2V2γ-1 (5)
P1V1y = P2V2y (6)
Och även de ungefärliga värmarna på cP och CV De varierar beroende på om gaserna är monoatomiska, diatomiska, etc.
Övning 1
En gas utför 600 J arbete genom ett isolerat fack. Vad är förändringen i dess inre energi? Minskar eller ökar temperaturen? Och med tanke på att det är en monoatomisk gas, beräkna också y.
Data:
W = +600J
ΔU = ¿?
γ =?
W arbete är positivt eftersom gas fungerar på omgivningen. Att vara inuti ett isolerat fack, Q = 0, och därför kommer vi att ha ekvation (1):
ΔU = - W
Det vill säga, ΔU är lika med:
ΔU = - (+600J)
= -600J
Vilket innebär att den inre energin från gas minskade 600 j. Om ΔU minskar, så gör temperaturen också, så gasen svalnar till följd av att du har gjort arbetet.
Eftersom denna gas är monoatomisk,
CV = 3/2 r
CP = 5/2 r
Och att vara
y = cP/CV
= (5/2 r)/(3/2 r)
= 5/3 eller 1.66
Övning 2
I en behållare 7 mol O2 De komprimeras från en volym av 15 liter till 9 liter. Att veta att den initiala temperaturen var 300 K, beräkna: arbetet som gjorts på gas.
Data:
n = 7 mol eller2
T1 = 300 K
V1 = 15 L
V2 = 9 L
W = ¿?
Det är en irreversibel adiabatisk förståelse. Vi har två ekvationer för att lösa W:
W = -nCVΔT (2)
W = (cV/R) (p1V1 - P2V2) (3)
Trycket kan beräkna dem, men för att spara tid är det bättre att fortsätta med den första av ekvationerna:
Kan tjäna dig: destillerat vattenW = -nCVΔT
= -nCV (T2-T1)
Vi behöver CV och t2 Att bestämma w. Syre, som är en diatomisk gas, har en CV lika med 5/2 r:
CV (ANTINGEN2) = 5/2 r
= 5/2 (8.314 j/mol · k)
= 20.785 j/mol · k
Vi måste beräkna T2. Vi vänder oss till ekvation (5):
T1V1γ-1 = T2V2γ-1
Men innan du använder den måste du bestämma först CP och y:
CP (ANTINGEN2) = 7/2 r
= 7/2 (8.314 j/mol · k)
= 29.099 J/mol · k
Att vara y lika med:
y = cP/CV
= (29.099 J / mol · k) / 20.785 j/mol · k
= 1.4
Så vi kan rensa detta2 Från ekvation (5):
T1V1γ-1 = T2V2γ-1
T2 = (T1V1γ-1) / (V2γ-1)
= [(300k) (15L)1.4-1] / (9l)1.4-1
= 368.01 K
Och slutligen löser vi för W:
W = -nCVΔT
= -(7 mol o2) (tjugo.785 J/mol · k) (368.01 K - 300 K)
= -9895.11 j o -9.895 kJ
Övning 3
En neonbehållare expanderar adiabatisk och initialt vid rumstemperatur (t = 298K) från 12 L till 14 L. Att veta att dess initiala tryck var 3 atm, vad kommer att vara det arbete som gjorts av gasen?
Data:
T1 = 298 K
V1 = 12 L
V2 = 14 L
P1 = 3 atm
W = ¿?
Ekvation (3) tillåter oss att bestämma W med tryckvärdena:
W = (cV/R) (p1V1 - P2V2)
Men vi saknar cV Och s2.
Det slutliga trycket kan beräknas med ekvation (6):
P1V1y = P2V2y
Att vara y lika med CP/CV. Eftersom neon är en monoatomisk gas har vi dess c -värdenP och CV De är 5/2R respektive 3/2R. Vi beräknar sedan γ:
y = cP/CV
= (5/2R)/(3/2R)
= 5/3 eller 1.66
Vi rensar P2 Från ekvation (6):
P2 = (P1V1y) / V2y
= [(3 atm) (12 L)5/3] / (14 L)5/3
= 1.40 atm
Och arbetet kommer att vara lika med:
W = (cV/R) (p1V1 - P2V2)
= (3/2) [(3 atm) (12 L) - (1.40 atm) (14 L)] (101300 Pa/1 atm) (0.001 m3/L) (kJ/1000 j)
= 2.49 kJ
Omvandlingsfaktorer används för att konvertera L · atm a pa · m3, vilket motsvarar 1 j. Neongas expanderar, så att trycket minskar och när du gör arbete med omgivningen är detta positivt. Dessutom minskar dess inre energi ΔU, liksom dess temperatur, kylning i expansionsprocessen.
Referenser
- Walter J. Moore. (1963). Fysisk kemi. I kemisk kinetik. Fjärde upplagan, Longmans.
- Iran. Levin. (2009). Principer för fysikalik. Sjätte upplagan. MC Graw Hill.
- Wikipedia. (2020). Adiabatisk process. Hämtad från: i.Wikipedia.org
- Jones, Andrew Zimmerman. (18 augusti 2020). Temodynamik: adiabatisk process. Återhämtat sig från: tankco.com
- Devoe Howard & Neils Tom. (9 augusti 2020). Adiabatiska förändringar. Kemi librettexts. Återhämtad från: kem.Librettexts.org
- « Vad är den mekaniska motsvarigheten till värme?
- Maderismo historia, ideologi, representanter, konsekvenser »

