Isobariska processformler, ekvationer, experiment, övningar

- 3921
- 34
- PhD. Emil Svensson
I en isobarisk process, trycket P av ett system förblir konstant. Prefixet "ISO" kommer från grekiska och används för att beteckna att något förblir konstant, medan "baros", också från grekiska, betyder vikt.
De isobariska processerna är mycket egna både i stängda behållare och i öppna utrymmen, är enkla att hitta dem i naturen. Med detta menar vi att fysiska och kemiska förändringar är möjliga på den jordiska ytan eller kemiska reaktioner i öppna behållare till atmosfären.
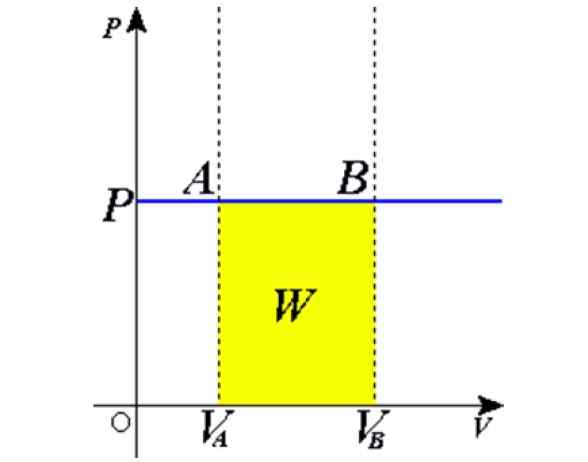 Figur 1. Isobarisk process: Den blå horisontella linjen är en isobara, vilket betyder konstant tryck. Källa: Wikimedia Commons.
Figur 1. Isobarisk process: Den blå horisontella linjen är en isobara, vilket betyder konstant tryck. Källa: Wikimedia Commons. Några exempel erhålls genom att värma upp till solen en ballong full av luft, matlagning, kokande eller frysande vatten, ångan som genereras i pannorna eller processen att höja en luftballong. Senare kommer vi att ge en förklaring av dessa fall.
[TOC]
Formel och ekvationer
Vi erhåller en ekvation för den isobariska processen förutsatt att systemet som studeras är en idealisk gas, en ganska lämplig modell för nästan alla gaser på mindre än 3 tryckatmosfärer. De ideala gaspartiklarna rör sig slumpmässigt, upptar hela volymen av utrymmet som innehåller dem utan att interagera med varandra.
Om den perfekta gasen som är låst i en cylinder försedd med en rörlig kolv får expandera långsamt, kan det antas att dess partiklar hela tiden är i balans. Sedan utövar gasen på området Kolv TILL en kraft F Magnitud:
F = p.TILL
Var p Det är gastrycket. Denna styrka utövar ett jobb som producerar en oändlig förskjutning Dx I kolven som ges av:
dw = fdx = PA.Dx
Som produkten Adx Det är en volymskillnad Dv, så Dw = pdv. Det återstår att integrera båda sidor från den initiala volymen VTILL Fram till den slutliga volymen VB För att få det totala arbetet som gjorts av gasen:


[TOC]
Experiment
Den beskrivna situationen är verifierad experimentellt konfigurera en gas i en cylinder försedd med en rörlig kolv, som visas i figurerna 2 och 3. En kolv placeras på kolven, vars vikt riktas ner, medan gasen utövar en kraft upp tack vare P -trycket som producerar på kolven.
Det kan tjäna dig: Imantation: Vad består, metod och exempel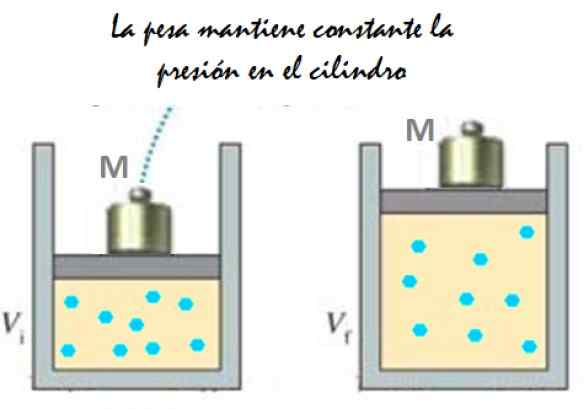 figur 2. Experiment som består av att utvidga en konstant tryckgas. Källa: f. Zapata.
figur 2. Experiment som består av att utvidga en konstant tryckgas. Källa: f. Zapata. Eftersom kolven kan röra sig fritt kan volymen som gas upptar förändras utan problem, men trycket förblir konstant. Lägga till atmosfärstryck pBankomat, Det utövar också en kraft, du har:
Mg - p.A + pBankomat . A = konstant
Därför: p = (mg/a) + pBankomat Det varierar inte, såvida inte m och med den är modifierad. Att lägga till värme till cylindern kommer gasen att utvidga ökar sin volym eller den kommer att sammandras när du extraherar värme.
Isobariska processer i den ideala gasen
Den ideala gasstatusekvationen relaterar till viktiga variabler: tryck P, volym V och temperatur T:
P.V = n .R.T
Här representerar n antalet mol och r är konstanten för de ideala gaserna (giltiga för alla gaser), som beräknas genom att multiplicera Boltzmann -konstanten med Avogadro -antalet, vilket resulterar i:
R = 8.31 j/mol k
När trycket är konstant kan tillståndsekvationen skrivas som:
V/t = nr/p
Men nr/p är konstant, eftersom n, r och p är. Så när systemet går från ett tillstånd 1 till en annan stat 2, uppstår följande andel, även känd som Charles lag:
V1/T1 = V2/T2
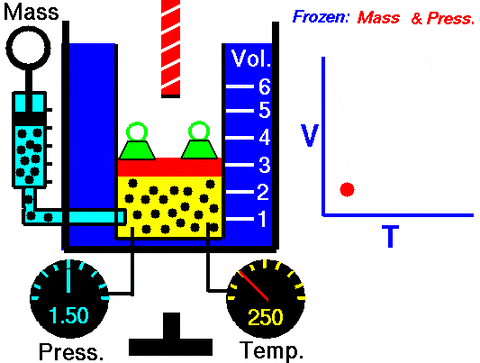 Figur 3. Animering som visar utvidgningen av konstant tryckgas. Till höger grafen för volymen beroende på temperaturen, som är en linje. Källa: Wikimedia Commons. NASA: s Glenn Research Center [Public Domain].
Figur 3. Animering som visar utvidgningen av konstant tryckgas. Till höger grafen för volymen beroende på temperaturen, som är en linje. Källa: Wikimedia Commons. NASA: s Glenn Research Center [Public Domain]. Byte in W = pδv, Det arbete som görs för att gå från tillstånd 1 till 2, när det gäller konstanterna och temperaturvariationen, lätt att mäta med en termometer:
W1 → 2 = nr (t2 - T1) = nr.ΔT
Å andra sidan konstaterar den första lagen om termodynamik att:
∆u = q - w
Detta innebär att lägga till gasen en viss mängd värme Q, den inre energin ∆U ökar och vibrationerna i dess molekyler ökar. På detta sätt expanderar och utför gasen arbete genom att förskjuta kolven, som vi har sagt tidigare.
I en idealisk monoatomisk gas och variationen av inre energi ∆U, som inkluderar både kinetisk energi och den potentiella energin i dess molekyler, är:
∆u = (3/2)Nr ΔT
Slutligen kombinerar vi i ett uttryck som vi har fått:
Q = ∆U + W = (3/2)Nr ΔT + Nr∆t = (5/2) Nr ΔT
Alternativt kan det skrivas om i termer av massa M, temperaturskillnaden och en ny konstant som kallas Specifik värmevärme Vid konstant tryck, förkortad cp, vars enheter är j/mol k:
Kan tjäna dig: Venus (planet)Q = m cp ∆t
Exempel
Inte alla isobariska processer genomförs i stängda containrar. I själva verket inträffar otaliga termodynamiska processer av alla slags atmosfärstryck, så de isobariska processerna är mycket ofta i naturen. Detta inkluderar fysiska och kemiska förändringar på jordens yta, kemiska reaktioner i öppna öppningsbehållare och mycket mer.
För att isobariska processer ska ske i stängda system är det nödvändigt att deras gränser är tillräckligt flexibla för att möjliggöra volymförändringar utan att trycket varieras.
Det här var vad som hände i kolvsexperimentet som lätt rörde sig när gasen expanderade. Detsamma händer genom att omsluta en gas i en fest för fester eller en luftballong.
Här har vi flera exempel på isobariska processer:
Koka vatten och koka
Kokande vatten för te eller matlagningssås i öppna behållare är bra exempel på isobariska processer, eftersom alla utvecklas vid atmosfärstryck.
Vid uppvärmning av vattnet, temperaturen och volymen ökar och om värmen fortsätter nås äntligen kokpunkten, där vattenfasändringen inträffar. Även om detta inträffar förblir temperaturen också konstant på 100 º C.
Frysa vatten
Å andra sidan är frysvatten också en isobarisk process, oavsett om det sker i en sjö under vintern eller det inhemska kylen.
Värm en ballong full av luft till solen
Ett annat exempel på den isobariska processen är förändringen i volymen på en luftuppblåst ballong när den lämnas utsatt för solen. Det första på morgonen, när det inte är så varmt, har världen en viss volym.
När tiden går och temperaturen ökar, värmer världen också upp att öka sin volym och allt detta händer under konstant tryck. Globe -materialet är ett bra exempel på gränsen som är flexibel för att göra luften inuti, när den är uppvärmd, expanderar utan att modifiera trycket.
Erfarenheten kan också utföras genom att justera världen utan inflar i toppen av en glasflaska full med en tredjedel av vatten, som värms upp till Maria Bio of Mary. Så snart vattnet är uppvärmt, uppblåst ballongen omedelbart, men man bör se till att inte värmas för mycket så att det inte exploderar.
Den aerostatiska ballongen
Det är ett flytande fartyg utan framdrivning, som använder luftströmmar för att transportera människor och föremål. Globen är vanligtvis fylld med varm luft, som är kallare än den omgivande luften, stiger och expanderar att göra världen grov.
Kan tjäna dig: trippelpunktMedan luftströmmar riktar sig till världen, har den brännare som är aktiverade för att värma upp gasen när du vill stiga upp eller bibehålla höjden och inaktiveras när du faller ner eller landar. Allt detta händer vid atmosfärstryck, antagen konstant i en viss höjd inte långt från ytan.
 Figur 4. Varmluftsballonger. Källa: Pixabay.
Figur 4. Varmluftsballonger. Källa: Pixabay. Panna
I pannorna genereras ånga genom att värma vatten och bibehålla det ständiga trycket. Sedan gör denna ånga ett användbart jobb, till exempel att generera elektricitet i termoelektriska växter eller agera andra mekanismer som lok och vattenpumpar.
Löst övningar
Övning 1
Det finns 40 liter gas vid 27 ° C temperatur. Hitta volymökningen när du tillsätts värme isobáriskt tills den når 100 ºC.
Lösning
Charles lag används för att bestämma den slutliga volymen, men uppmärksamhet: Temperaturer måste uttryckas i Kelvin, lägg bara till 273 K till varje:
27 ºC = 27 + 273 K = 300 K
100 ºC = 100 + 273 K = 373 K
Från:
V1/T1 = V2/T2 ⇒ v2 = T2(V1/T1) = 373 ºC (40 L/300 K) = 49.7 L
Slutligen är volymökningen v2 - V1 = 49.7 L - 40 L = 9.7 L.
Övning 2
5 levereras 5.00 x 103 J från energi till en idealisk gas för att göra 2.00 x 103 J av arbetet med din miljö i en isobarisk process. Det uppmanas att hitta:
a) Förändringen i den inre energin i gas.
b) Volymförändringen, om nu den inre energin minskar med 4.50 x 103 J och 7 utvisas.50 x 103 J av systemet med tanke på konstant tryck på 1.01 x 105 Pa.
Lösning till
Begagnade ∆u = q - w och värdena i uttalandet ersätts: Q = 5.00 x 103 J och W = 2.00 x 103 J:
=5.00 x 103 J - 2.00 x 103 J = 3.00 x 103 J
Därför ökar den inre energin i gasen med 3.00 x 103 J.
Lösning B
Volymförändring finns i det gjorda arbete: W = p∆v:
∆U = Q - W = Q - P∆v
Uttalandet bekräftar att intern energi minskar därför: ∆U= -4.50 x 103 J. Det säger också att en viss mängd värme utvisas: Q = -7.50 x 103 J. I båda fallen representerar det negativa tecknet minskning och förlust, sedan:
-4.50 x 103 J = -7.50 x 103 J - P∆V
Var P = 1.01 x 105 Pa. Eftersom alla enheter finns i det internationella systemet är volymförändringen tydlig:
∆V = (-4.50 x 103 J +7.50 x 103 J)/ (- 1.01 x 105 Pa) = -2.97 x 10-2 m3
När volymförändringen är negativ betyder det att volymen minskade, det vill säga systemet kontrakterade.
Referenser
- Byjous. Isobarisk process. Återhämtat sig från: byju.com.
- Cengel och. 2012. Termodynamik. Sjunde upplagan. McGraw Hill.
- Xyz -process. Lär dig mer om den isobariska processen. Återhämtad från: 10 -processen.X och z.
- Serway, R., Vule, c. 2011. Fysikens grunder. 9na ed. Cengage Learning.
- Wikipedia. Gaslagar. Återhämtad från: är.Wikipedia.org.
- « 14 psykologiska experiment med mycket kontroversiella människor
- Embullitionskoncept, typer och exempel »

