Catalase Test Foundation, teknik och användningar

- 1913
- 588
- Per Eriksson
De katalas Det är en metod som används i bakteriologiska laboratorier för att lyfta fram närvaron av enzymkatalas i de bakterier som har det. Bredvid Grams färg är de viktigaste testerna som bör utföras på nyligen isolerade mikroorganismer. Dessa tester leder mikrobiologen på stegen att följa för den definitiva identifieringen av mikroorganismen i fråga.
I allmänhet har bakterier som innehåller cytokrome katlasymenzymet, det vill säga aeroba och valfria anaeroba bakterier bör ha den. Det finns emellertid undantag, till exempel Streptococcus, som trots att de är valfria anaeroba mikroorganismer inte har katalasenzymet.
 Exekvering av katalastestet, visar en positiv reaktion. Källa: Ingen maskinläsbar författare tillhandahållen. Nase antas (baserat på upphovsrättsanspråk). [CC BY-SA 3.0 (http: // Creativecommons.Org/licenser/BY-SA/3.0/]]
Exekvering av katalastestet, visar en positiv reaktion. Källa: Ingen maskinläsbar författare tillhandahållen. Nase antas (baserat på upphovsrättsanspråk). [CC BY-SA 3.0 (http: // Creativecommons.Org/licenser/BY-SA/3.0/]] Det är därför katalastestet huvudsakligen används för att skilja Staphylococaee och Micrococaceae (båda positiva katalas) av Streptococaee -familjen (negativt katalas) (negativt katalas).
På samma sätt skiljer sig släktet Bacillus (positivt katalas) från släktet Clostridium (negativt katalas), bland andra.
[TOC]
Grund
Katalas är ett enzym klassificerat som ett hydroperoxidas, detta innebär att de använder väteperoxid som ett substrat (h2ANTINGEN2).
Det betraktas också som ett oxidoreduktas, eftersom i reaktionen där det finns ett element som fungerar som en givare av elektroner (reducerar substans) och ett annat som en elektronmottagare (oxiderande substans).
Catalase är ett protein som innehåller en prostorisk grupp med fyra trivalenta järnatomer (tro+++), därför är det ett homoprotein. Järnjonen förblir oxiderad under reaktionen.
Det kan sägas att katalas är ett avgiftande enzym, eftersom dess funktion är att eliminera ämnen som inträffar under bakteriell metabolism som är giftiga för bakterier. Bland dessa ämnen är väteperoxid.
Väteperoxid bildas från nedbrytningen av sockerarter med aerobics. Denna process inträffar på följande sätt:
Superoxidjonen (eller2-) (Fri radikal) bildas som en slutprodukt av assimilering av glukos av aerob väg. Detta är giftigt och elimineras av enzymets superoxiddysmutas som förvandlar det till gasformigt syre och väteperoxid.
Det kan tjäna dig: Holridge Life Zones: Vad finns i LatinamerikaVäteperoxid är också giftigt för bakterier och måste elimineras. Katalasenzymet utspelar väteperoxid i vatten och syre.
Katalas kan verka på andra substrat än väteperoxid, såsom alkoholer, aldehyder, syror, aromatiska aminer och fenoler. Väteperoxid kan emellertid också användas av katalas för att oxidera andra toxiska föreningar såsom metyl- och etylalkohol.
På samma sätt finns katalas i fagocytiska celler och skyddar det från den toxiska verkan av väteperoxid.
Rutinmässig teknik för katalastest
-Metod i bilden
Materiel
3% väteperoxid (10 volymer).
Bärbar lamina
Engångsplasthandtag eller träpinne.
Procedur
Ta tillräckligt med belopp från kolonin för att studera utan att vidröra agaren från vilken den kommer från. Kolonin måste vara färsk, det vill säga från en gröda på 18 till 24 timmar.
Placera kolonin på den torra hållaren och lägg till en droppe av 3% väteperoxid (du kan också använda H2ANTINGEN2 vid 30%). Observera omedelbart om bubblor är lossna eller inte.
Tolkning
Positiv reaktion: Gasavskiljning, vilket är tydligt med bildandet av bubblor (stark bubbla).
Negativ reaktion: Det finns ingen bubbelbildning.
-Direkt metod i ren kultur
Placera 1 ml h2ANTINGEN2 3% på ren gröda i plattor eller kilar som inte innehåller blod (helst näringsrikt grepp). Observera om det finns bubbelbildning eller inte. Du kan också använda h2ANTINGEN2 30%.
Det tolkas precis som objekthållarmetoden.
-Metod med kapillär eller svamp och Petrishko -rör
Fyll ett 67 mm kapillärrör på en höjd av 20 mM med 3% väteperoxid per kapillaritet.
Rör vid den isolerade kolonin som du vill studera med kapillären full av h2ANTINGEN2 3%. Observera om kapillären är fylld med bubblor på cirka 10 sekunder. Denna metod gör det möjligt att halvkvantifiera reaktionen vid kors:
Utan kors finns det inga bubblor (negativ reaktion).
Kan tjäna dig: Flora och fauna på Falklandsöarna: Enastående arter+ --Knappa bubblor (svag eller försenad reaktion).
++ -Rikliga bubblor (måttlig reaktion).
+++ -Bubblor når motsatt ände (energisk reaktion).
-Taylor och Achanzar -metod för katalastest som ger tveksamt
I en ren och torr bild placerade en isolerad koloni och placera sedan en droppe H2ANTINGEN2 0,5% och täcker med en omslag. Observera om det finns en bildning av fängslade bubblor eller inte.
Tolkning: Närvaron av bubblor indikerar en positiv reaktion. Utan bubblor tolkas det som en negativ reaktion.
Katalastest för Mycobacterium -arter
Denna teknik måste göras genom att kontrollera pH och temperatur. Det måste utföras under en laminär flödesklocka, eftersom manipulationen av de olika arterna av Mycobacterium är farligt.
-Materiel
30% eller 110 volymväteperoxid (superoxal).
Fosfatbuffert pH 7
Mellan 80 till 10%
Mycobacterium -kulturen i kil från 3 till 4 veckor
-Förberedelse av reagens
Fosfatbuffert pH 7
Väga:
1 361 g (kh2Po4) Anhydra.
1 420 g (Na2HPO3) dysodisk fosfatörlig.
Lös upp båda salterna i lite sterilt destillerat vatten och komplett med vatten upp till 1000 ml.
Mellan 80 till 10%
Utför en utspädning på 1:10 till Tween 80 som kommer kommersiellt koncentrerad för att detta ska fortsätta enligt följande:
Ta 1 ml Tween 80 och placera det i lite destillerat vatten, lösa upp och slutför sedan volymen med vatten upp till 10 ml.
Slutliga reagens
Blanda en mängd fosfatbuffert med en mängd mellan 80 till 10% (i lika delar). Definiera i laboratoriet hur mycket du vill förbereda.
-Procedur
Placera 5 ml fosfatbuffert i ett sterilt provrör med trådlock (Baquelita).
Med ett inokuleringshandtag, ta tillräckligt med koloni av en tillväxt av Mycobacterium sådd i kilar och upplöses i fosfatbufferten.
Täck röret utan att dra åt tråden. Placera i ett badrum vid 68 ° C i 20 till 30 minuter. Ta ut och svalna vid 22-25 ° C
Mät 0,5 ml av det slutliga reagenset (blandningen) och tillsätt det i röret med den kalla lösningen. Observera eller inte bubbelbildning.
Det tolkas såväl som de tidigare teknikerna.
Använda sig av
När en tillväxt av kolonier i anrikade medier erhålls måste en gramfärgning och ett katalastest genomföras till de erhållna kolonierna. Detta kommer att vägleda mikrobiologen om de procedurer som ska följas för definitiv identifiering.
Kan tjäna dig: Enkelt platt epitel: Egenskaper, funktioner och typer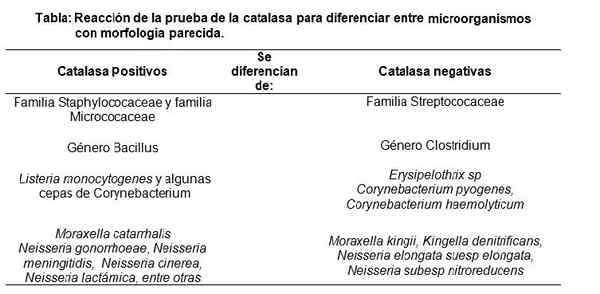 Källa: Utarbetad av författaren MSC. Marielsa Gil
Källa: Utarbetad av författaren MSC. Marielsa Gil QA
För att utvärdera korrekt funktion av väteperoxidreagenset, använd ny odlade kontroller, till exempel Staphylococcus aureus som positiv kontroll och stammar av Streptococcus sp Som negativ kontroll.
Ett annat alternativ som fungerar som en positiv kontroll är att placera en droppe väteperoxid på blodagar, erytrocyter har katalas, därför kommer det att finnas ett bubblande om reagenset är i gott skick.
Du kan använda en chokladagar som en negativ kontroll, här är erytrocyterna redan listade och testet ger negativt.
Begränsningar
-Använd inte gamla grödor för testet, eftersom det kan orsaka falska negativa.
-Undvik att ta kolonier från grödor i blodagar, om du är noga med att inte röra agar; Denna procedur kan orsaka falska positiver, eftersom erytrocyter innehåller katalas.
-Om du tar kolonin med platinahandtag, investerar du inte ordningen på proceduren eftersom detta kan generera falska positiver. Detta beror på att Platinum kan reagera med väteperoxid och har sitt ursprung i en bubbla.
-Använd inte väteperoxidreagenset om det är väldigt gammalt, eftersom reagenset är mycket instabilt och tenderar att bryta ner över tiden.
-Håll reagenset av väteperoxid skyddat från ljus och kylning för att förhindra skador.
-Utför kvalitetskontroll till väteperoxidreagenset varje gång det används.
-Ta hänsyn till att om H används2ANTINGEN2 Vid 30% är reaktionerna starkare än de som utförs med H2ANTINGEN2 3%.
Referenser
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiologisk diagnos. 5: e upplagan. Pan -amerikanska redaktionella.TILL. Argentina.
- Forbes B, Sahm D, Weissfeld A. (2009). Bailey & Scott mikrobiologisk diagnos. 12 ed. Pan -amerikanska redaktionella.TILL. Argentina.
- Mac Faddin J. (2003). Biokemiska tester för identifiering av klinisk betydelse bakterier. 3: e upplagan. Pan -amerikansk redaktion. Buenos Aires. Argentina.
- BD Laboratories. Katalasreagens. Finns på: http: // winklerltda.Kli
- Vadequímica Laboratories. Väteperoxid. Ekvivalens mellan volymer och procentandel. Finns på: Vadequimica.com

