Vad är kemisk kinetik?

- 5074
- 390
- Johan Olsson
Vi förklarar vad som är kemisk kinetik, ordning och reaktionshastighet och de faktorer som påverkar hastigheten
Vad är kemisk kinetik?
De kemisk kinetik Det är grenen av kemi som ansvarar för att studera hastigheten på kemiska reaktioner, vilka faktorer som påverkar denna hastighet och vad är de enskilda mekanismerna eller stegen genom vilka kemiska reaktioner inträffar.
Dessutom tillåter det oss att förstå många aspekter av kemiska reaktioner såsom kemisk balans och aktiveringsenergi och studera katalysprocesser. Det senare gör det särskilt viktigt i flera tillämpningar, från biokemi till industriell teknik.
I mitten av kinetiken är reaktionshastigheten, som kan förstås som hastigheten med vilken reagensen omvandlas till produkter. Men i kemiska kinetik finns det en mycket mer exakt definition.
Definition av reaktionshastighet
För att ge den fullständiga definitionen av reaktionshastigheten, som används i kemisk kinetik, låt oss börja med följande generiska kemiska reaktion:
I denna reaktion representerar A och B reagensen, C och D representerar produkter, medan A, B, C och d De representerar respektive stökiometriska koefficienter.
Reaktionshastigheten (representerad med symbolen v) Indikerar hur snabbt. Matematiskt uttrycks detta enligt följande:
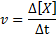
Där Δ [x] representerar förändringen i molkoncentration av arter x (a, b, c eller d) i tidsintervallet ΔT.
Det är uppenbart att ju snabbare någon av reagensen konsumeras, desto snabbare kommer de andra reagensen att konsumeras och desto snabbare kommer produkterna att inträffa. Av denna anledning är det bara nödvändigt att definiera hastigheten i termer av en av dem.
Det kan tjäna dig: metoder för separering av homogena blandningarFör att säkerställa att resultatet av beräkningen av hastigheten alltid är densamma, oavsett vilken art hastigheten definieras, måste den alltid delas mellan den stökiometriska koefficienten och placera ett tecken mindre före ekvationen om den är ett reagens. Det vill säga:
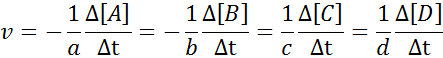
Exempel på definition av reaktionshastighet
Med tanke på följande kemiska reaktion:
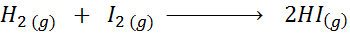
Skriv definitionen av reaktionshastigheten beroende på varje inblandad art.
Lösning:
I termer av h2:
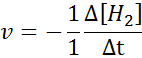
I termer av i2:
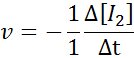
När det gäller HI:
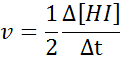
Hastighetslagen och reaktionens ordning
Reaktioner uppstår när atomer och molekyler kolliderar med varandra med tillräcklig energi och korrekt orientering. Sannolikheten för att detta händer ökar när atomer och molekyler är mer koncentrerade.
Av denna anledning beror hastigheten nästan alltid på koncentrationen av reagens. I vissa fall beror hastigheten också på koncentrationen av någon av produkterna, liksom koncentrationen av alla katalysatorer eller hämmare som finns i miljön.
Den matematiska ekvationen som relaterar hastigheten på en reaktion på koncentrationen av de olika involverade arterna kallas "Hastighetslag”Och i enklare fall har det följande form:
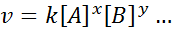
Var k Det är en proportionalitetskonstant som kallas hastighetskonstant, och exponenterna för A, B och alla andra arter som förekommer i ekvationen kallas reaktionsorder.
Enligt summan av alla reaktionsorder (som kallas global ordning) kan olika typer av reaktioner särskiljas. Dessa skiljer sig från hur mycket koncentrationen påverkar hastigheten, i formeln för den tid det tar att konsumera hälften av reagensen (halva livet) och i hur koncentrationen av reagensen förändras över tid (graferna [a] vs t ).
-
Beställningsreaktioner 0
När alla exponenter i hastighetslagen är 0 reduceras ekvationen för hastighetslagen till:
Kan tjäna dig: koordinerad kovalent länk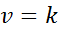
Med andra ord är de reaktioner som uppstår med konstant hastighet och där hastigheten inte beror på koncentrationen av något reagens eller produkt.
Beställningsgrafer 0
Grafen för [a] vs t order reaktioner 0 är fallande raka linjer.
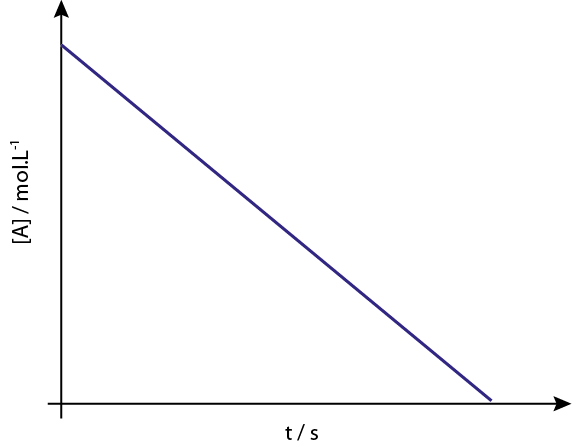
Legend: Koncentrationsgrafen mot tid för en reaktion av ordning 0 ger en rak linje.
Mellanliv för beställning 0
För en reaktion av ordning 0, halvlivstiden (t1/2) Ges av:
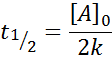
-
1: a beställningsreaktioner
I dessa reaktioner varierar hastigheten linjärt med koncentrationen. Lagen om första orderhastighet är:
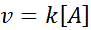
Första ordningens grafik
Grafen för [a] vs t av de första -ordningens reaktioner är fallande hyperbolas. Men om den neperiska koncentrationslogitmen (ln [a]) vs tid är graf, erhålls en rak linje.
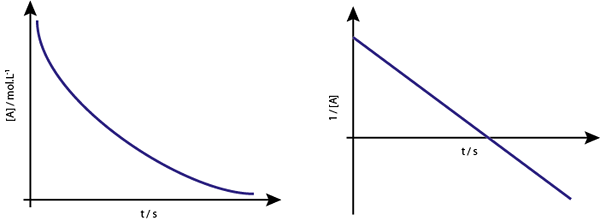 Koncentrationsgrafen kontra tiden för en reaktion av ordning 1 ger en hyperbola, men grafen för den neperiska logaritmen för koncentrationen kontra tiden ger en linje en linje
Koncentrationsgrafen kontra tiden för en reaktion av ordning 1 ger en hyperbola, men grafen för den neperiska logaritmen för koncentrationen kontra tiden ger en linje en linje Mittliv för första ordningsreaktioner
För en reaktion av ordning 1, t1/2 Det beror inte på den initiala koncentrationen och ges av:
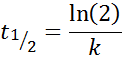
-
Andra ordningsreaktioner
En reaktion kan vara andra ordning med avseende på ett enda reagens eller första ordning med avseende på två reagens. I det första fallet ges hastighetslagen av:
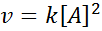
Andra ordningens grafik
Grafen för [a] vs t för andra ordningsreaktioner är fallande hyperbolas. Men om den inversa av koncentrationen (1/[a]) vs tid plottas, erhålls en rak linje.
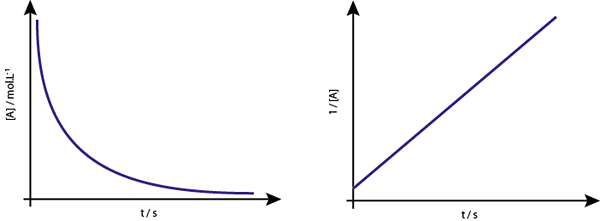 Koncentrationsgrafen kontra tiden för en reaktion av ordning 2 ger en kurva som liknar en fallande hyperbola, men grafen för koncentrationen kontra tiden ger en linje
Koncentrationsgrafen kontra tiden för en reaktion av ordning 2 ger en kurva som liknar en fallande hyperbola, men grafen för koncentrationen kontra tiden ger en linje Mittliv för andra ordningens reaktioner
För en reaktion av ordning 2, t1/2 Ges av:
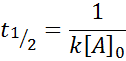
Faktorer som påverkar reaktionshastigheten
Temperatur
Temperaturen ökar alltid hastigheten vid vilken reaktionerna inträffar, eftersom frekvensen och energin som molekylerna kolliderar med varandra ökar. Beroendet av reaktionshastigheten med temperaturen ges av Arrhenius -ekvationen.
Det kan tjäna dig: magnesiumhydrid: struktur, egenskaper och användningarTryck
Ökande tryck motsvarar att öka koncentrationen av alla arter i reaktionsmediet (för gasfasreaktioner), så tryckökningar tenderar att öka reaktionens hastighet.
Katalysatorer
Katalysatorer är kemiska ämnen som tillsätts till mediet bara för att öka reaktionshastigheten. De flesta katalysatorer fungerar genom att ändra reaktionsmekanismen med en som kräver lägre aktiveringsenergi.
Vanliga katalysatorexempel är enzymer i levande system och vissa metaller som platina och paladium.
Hämmare
Hämmare är motsatsen till katalysatorer. De är ämnen som gör reaktioner långsammare. Antikorrosiv är exempel på hämmare som försöker minska hastigheten på korrosionsreaktioner, för att göra metallytor mer.


