Vad är anoden och katoden?

- 2178
- 103
- Johan Olsson
han anod och katod De är de typer av elektroder som finns i elektrokemiska celler. Dessa är enheter som kan producera elektricitet genom en kemisk reaktion. De mest använda elektrokemiska cellerna är batterier.
Det finns två typer av elektrokemiska celler, elektrolytiska celler och galvaniska eller voltaiska celler. I elektrolytiska celler inträffar den kemiska reaktionen som produceras av energi inte spontant, men den elektriska strömmen förvandlas till en kemisk oxidationsreaktion.

Den galvaniska cellen består av två semi -lodgs. Dessa är förbundna med två element, en metallförare och en saltbro.
Den elektriska ledaren, som indikeras av hans namn, leder elektricitet eftersom han har mycket liten motstånd mot rörelsen av den elektriska laddningen. De bästa förarna är vanligtvis metaller.
Saltbryggan är ett rör som förbinder de två halvladorna, samtidigt som de bibehåller sin elektriska kontakt och utan att låta komponenterna i varje cell gå med.Varje halvmedia av den galvaniska cellen innehåller en elektrod och en elektrolyt.
När den kemiska reaktionen inträffar förlorar en av semi -lladerna elektroner till dess elektrod genom oxidationsprocessen; Medan de andra vinner elektroner för elektrod, genom reduktionsprocessen.
Oxidationsprocesser produceras i anoden och reduktionsprocesserna i katoden
[TOC]
Anod
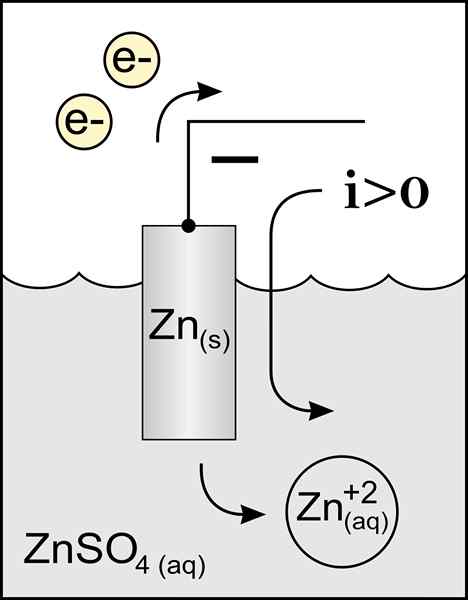 Diagram över en zinkanod i en voltaisk cell. Källa: Originalverk: Fil: Zink Anode 2.PNG av användare: MichelJullian (samtal) Derivatarbete: KES47/CC BY-S (http: // Creativecommons.Org/licenser/BY-SA/3.0/)
Diagram över en zinkanod i en voltaisk cell. Källa: Originalverk: Fil: Zink Anode 2.PNG av användare: MichelJullian (samtal) Derivatarbete: KES47/CC BY-S (http: // Creativecommons.Org/licenser/BY-SA/3.0/) Anodens namn kommer från den grekiska ανά (Aná): Up, och οδός (Odós): Path. Faraday var den som myntade denna term under 1800 -talet.
Den bästa definierande anoden är elektroden som förlorar elektroner i en oxidationsreaktion. Normalt är den kopplad till den positiva polen för den elektriska strömmen, men det är inte alltid fallet.
Kan tjäna dig: värderade lösningarÄven i batterierna är anoden den positiva polen, i LED -lamporna är det motsatsen, varan är den negativa polen.
Normalt definieras känslan av elektrisk ström, vilket uppskattar den som en känsla av fria belastningar, men om föraren inte är metallisk överförs de positiva laddningarna som produceras till den externa föraren.
Denna rörelse innebär att vi har positiva och negativa laddningar som rör sig i motsatta sinnen, så det sägs att riktningen är vägen för de positiva laddningarna för katjonerna som ligger i anoden mot den negativa belastningen på anoderna från anoder som finns i katoden.
I galvaniska celler, med en metallisk ledare, följer strömmen som genereras i reaktionen vägen från den positiva polen till det negativa.
Men i elektrolytiska celler, som inte har en metallisk ledare, utan en elektrolyt, kan joner med positiv och negativ belastning som rör sig i motsatta sinnen hittas.
Termoioniska anoder får de flesta elektroner som kommer från katoden, värmer anoden och måste hitta ett sätt att spridas. Denna värme genereras i spänningen som inträffar mellan elektroner.
Specialanoder
Det finns en typ av speciella anoder, till exempel de inom x -ramar. I dessa rör genererar den energi som produceras av elektroner, förutom att producera x -strålar, stor energi som värmer anoden.
Denna värme uppstår till den olika spänningen mellan båda elektroderna och som utövar tryck på elektroner. När elektroner rör sig i den elektriska strömmen träffar de anoden genom att överföra sin värme.
Kan tjäna dig: Henderson-Haselbalch-ekvation: Förklaring, exempel, träningKatod
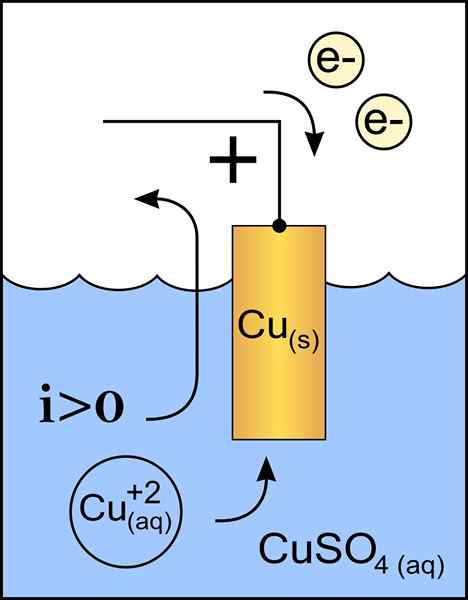 Kopparkatoddiagram i en voltaisk cell. Källa: Originalverk: Fil: Zink Anode 2.PNG av användare: MichelJullian (samtal) Derivatarbete: KES47/CC BY-S (http: // Creativecommons.Org/licenser/BY-SA/3.0/)
Kopparkatoddiagram i en voltaisk cell. Källa: Originalverk: Fil: Zink Anode 2.PNG av användare: MichelJullian (samtal) Derivatarbete: KES47/CC BY-S (http: // Creativecommons.Org/licenser/BY-SA/3.0/) Katoden är elektroden med negativ belastning, som i den kemiska reaktionen lider av en reduktionsreaktion, där dess oxidationsstatus reduceras när den tar emot elektroner.
Liksom med anoden var det Faraday som föreslog termen katod som kommer från den grekiska κατά [Catá]: 'Down' och ὁΔός [Odós]: 'Road'. Till denna elektrod tillskrivs den negativa belastningen över tid.
Detta tillvägagångssätt var falskt, eftersom den beror på den enhet som den finns, den har en eller annan belastning.
Detta förhållande till den negativa polen, som med anoden, uppstår från antagandet att strömmen flyter från den positiva polen till det negativa. Detta uppstår i en galvanisk cell.
Inom de elektrolytiska cellerna kan medel för överföring av energi, eftersom det inte är i en metall utan i en elektrolyt, samexistera negativa och positiva joner som rör sig i motsatta sinnen. Men med överenskommelse sägs det att strömmen går från anoden till katoden.
Specialkatoder
En typ av specifika katoder är termioniska katoder. I dessa avger katoden elektroner på grund av värmeens effekt.
I termiska ventiler kan katoden värma sig själv genom att cirkulera en uppvärmningsström i en glödtråd som har den kopplad till den.
Balansreaktion
Om vi tar en galvanisk cell, som är den vanligaste elektrokemiska cellen, kan vi formulera jämviktsreaktionen som genereras.
Varje semi -media som bildar den galvaniska cellen har en karakteristisk spänning som kallas reduktionspotential. Inom varje semi -media finns en oxidationsreaktion mellan de olika jonerna.
Kan tjäna dig: absorptionsspektrumNär denna reaktion når en balans kan cellen inte ge mer spänning. För närvarande kommer oxidationen som äger rum i semi -media i det ögonblicket att ha ett positivt värde desto närmare är balansen. Reaktionens potential blir större ju mer balans den uppnås.
När anoden är i balans börjar den förlora elektroner som passerar genom föraren till katoden.
I katoden sker reduktionsreaktionen, desto mest potentiell balans kommer att få reaktionen när man producerar och tar elektronerna som kommer från anoden.
Referenser
- Huheey, James och., et al.Oorganisk kemi: Principer för struktur och reaktivitet. Pearson Education India, 2006.
- Sienko, Michell J.; Robert, a.Kemi: Principer och egenskaper. New York, USA: McGraw-Hill, 1966.
- Brady, James och.Allmän kemi: Principer och struktur. Wiley, 1990.
- Petrucci, Ralph H., et al.Allmän kemi. Inter -American Education Fund, 1977.
- Masterton, William L.; Hurley, Cecile N.Kemi: Principer och reaktionioner. Cengage Learning, 2015.
- Charlot, Gaston; Tremillon, Bernard; Badoz-Lambling, J. Elektrokemiska reaktioner. Toray-Masson, 1969.

