Radikaler hyr hur de bildas, nomenklatur, exempel

- 1124
- 217
- PhD. Emil Svensson
De Radikaler hyr De är en uppsättning instabila molekyler som härstammar från förlusten av hydrogener i en alkan. De kännetecknas av att ha en försvunnen elektron, så de reagerar snabbt för att slutföra oktetten av Valencia i atomen där den ligger.
Dessa radikaler symboliseras med bokstaven R, liksom hyresgrupperna, men med skillnaden att en punkt läggs till, r ·. Denna punkt indikerar närvaron av en elektron försvann. Tänk till exempel på metangas, Cho4. Denna alkan, som förlorar en av sina hydrogener, kommer att omvandlas till den radikala metylen, CHO3· (Bild nedan).
 Allmän formel för en radikal alkyl och den radikala metylen. Källa: Gabriel Bolívar via Molview.
Allmän formel för en radikal alkyl och den radikala metylen. Källa: Gabriel Bolívar via Molview. Om du vill fördjupa lite om den radikala strukturen Ch3· Det kommer att ses att dess försvunna elektron är i vinkel vinkelrätt mot C-H-länkarna; det vill säga det ligger i en omlopp p ren. Därför cho3· Anta en SP -hybridisering2, såväl som i allmänhet med andra radikaler alkyl.
Dessa radikaler är hörnstenen i kedjereaktionerna där alkanerna deltar, som är fallet med deras halogeneringar: klorering, bromation, etc. Det finns 1: a, 2: a och 3: e radikaler, såväl som vinyl och alilik, var och en med sin respektive stabilitet och enkel träning.
[TOC]
Hur bildas radikaler alkyl?
Den "enklare" reaktionen för vilken radikaler bildas är halogenering av alkanerna. För att bilda måste kedjereaktionen ges, som endast inträffar vid höga temperaturer (överstiger 250 ºC), eller under förekomsten av ultraviolett ljus vid rumstemperatur.
Kan tjäna dig: natriumsulfit (Na2SO3)Tänk på klorering av metan under ett av de villkor som nämns ovan:
Kli2 → 2cl ·
Energin som tillhandahålls räcker för att bryta Cl-CL-länken för klormolekylen, som förekommer en homolitisk paus; det vill säga varje kloratom stannar hos en av länkelektronerna. Därför bildas två radikaler.
Sedan attackerar en radikal Cl · en metanmolekyl:
Cl · + ch4 → HCl + CH3·
Och den radikala metylen visas. Denna ch3· Det är ganska instabilt, så det kommer att reagera omedelbart för att vinna en extra elektron som den kommer att se ut sin ensamma elektron:
Ch3· + Cl2 → Ch3Cl + Cl ·
Det bildade kommer att reagera med en annan metanmolekyl och cykeln upprepas om och om igen. När metan rinner ut kommer följande reaktioner att inträffa som kommer att avsluta kedjereaktionen:
Cl · + · Cl → Cl2
Ch3· + · Cho3 → Ch3Ch3
Ch3· + · Cl → CH3Kli
Relativ stabilitet
Ch3
Metan är inte den enda alkanen som är "radikaliserad" genom klorering. Det händer också samma sak med etan, propan, butan och andra isomerer. Det som varierar är emellertid den nödvändiga energin som måste tillhandahållas så att radikalerna klyftar en molekyl av alkan. När det gäller metylradikalen är den mycket instabil och därför svårt att bilda.
Således den radikala cho3Ch2· Det är mer stabilt och enkelt att forma än Cho3·. Därför att? Eftersom den radikala ch3Ch2· Det är primärt, 1: a, vilket innebär att den försvinnande elektronen är på en kolatom som är kopplad till ett annat kol. Under tiden Cho3Så snart det är kopplat till väteatomer.
Kan tjäna dig: fluorid: historia, egenskaper, struktur, erhållning, risker, användningarVad handlar det här om? Den försvunna elektronen kommer ihåg den tidigare representationen p, vinkelrätt mot de andra länkarna. I ch3·, Väteatomer donerar knappt elektronisk densitet till kolatomen, i ett försök att kompensera för bristen på en annan elektron.
Första
I ch3Ch2· Å andra sidan är kol med den försvunna elektronen kopplat till två hydrogener och en metylgrupp. Följaktligen får detta kol större elektronisk densitet, vilket hjälper till att stabilisera elektronen försvann lite. Samma förklaring är giltig för andra första alkyndradikaler.
2: a
I en radikal sekundär eller 2: a alquil, såsom isopropilradikal, (ch3)2C. Därför är det mer stabilt än 1: a och metylradikaler.
3: e
Vi har också tertiära eller tredje alkyndradikaler, till exempel Ter-butyl-radikalen3)3C ·. Dessa är mer stabila än den första och 2: a. Nu finns det tre kolsyrade grupper som skiljer sig från väteatomen som stabiliserar den försvunna elektronen.
Allylisk och vinyl
Det är också värt att nämna de allyliska radikalerna, Cho2= Ch-ch2·, Och vinyl, cho2= Ch ·.
Alilic är den mest stabila av alla. Detta beror på att den försvunna elektronen till och med kan flytta till kolatomen i den andra änden. Vínilico är å andra sidan den mest instabila av alla, sedan Cho -gruppen2=, mer syra, lockar elektronisk densitet mot sig själv istället för att donera den mot kol med elektronen försvann.
Kan tjäna dig: bly hydroxid: struktur, egenskaper, användningar, riskerSammanfattningsvis är den relativa stabiliteten hos alkyndradikalerna, från högsta till lägsta,:
Alilo> 3rd> 2nd> 1st> vinyl
Nomenklatur
Nomenklaturen för radikalens alkyl är densamma som för botemedel. Således Cho3Ch2· Kallas etylradikal; och den radikala ch3Ch2Ch2Ch3, n-butyl.
Huvudradikaler hyr
De viktigaste alkylradikalerna sammanfaller med alkylgrupper: de är de som har mindre än sex kolatomer. Därför härstammar radikalerna från metan, etan, propan, butan och pentano. På samma sätt är den radikala vinylen och alilicos en del av denna lista.
Andra alkyndradikaler som finns mindre ofta är de som härstammar från cykloalcanos, såsom cyklobutan, cyklobutan eller cyklopentano.
I följande bild representeras flera av dessa radikaler med tilldelade bokstäver:
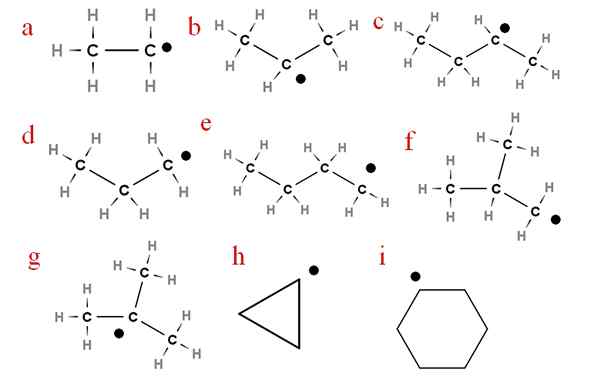 Nio av de viktigaste alchygradikalerna. Källa: Gabriel Bolívar.
Nio av de viktigaste alchygradikalerna. Källa: Gabriel Bolívar. Börjar med bokstaven 'A', vi har:
-A, etylradikal
-B, isopropylradikal
-C, secbutylradikal
-D, radikal propyl
-E, radikal n-butyl
-F, isobutil radikal
-G, ter-butylradikal
-H, radikal cycropilus
-Jag, radikal cyklohexil
Var och en av dessa radikaler kan eller inte få sina hydrogener ersatta av andra grupper, så de är lika varierande som alkanerna och deras strukturella isomerer.
Referenser
- Morrison, r. T. och Boyd, R, N. (1987). Organisk kemi. Femte upplagan. Redaktör Addison-Wesley Inter-American.
- Carey f. (2008). Organisk kemi. (Sjätte upplagan). MC Graw Hill.
- Graham solomons t.W., Craig b. Fryhle. (2011). Organisk kemi. (10: e upplagan.). Wiley Plus.
- Wikipedia. (2020). Alkyl. Hämtad från: i.Wikipedia.org
- Kemi librettexts. (5 juni 2019). Struktur av alkylradikaler: hyperkonjugering. Återhämtad från: kem.Librettexts.org
- « Cross References -koncept, funktioner, exempel
- Vattenlevande djurens egenskaper, andning, typer, exempel »

