Exotermiska och endotermiska reaktioner
- 4328
- 80
- Johan Eriksson
 Förbränning är ett exempel på exoterm reaktion, eftersom den släpper värmen. För sin del smälter is genom en endoterm reaktion, eftersom den kräver termisk energi
Förbränning är ett exempel på exoterm reaktion, eftersom den släpper värmen. För sin del smälter is genom en endoterm reaktion, eftersom den kräver termisk energi De exotermiska och endotermiska reaktioner De skiljer sig åt i det faktum att den första frisättningen av termisk energi, medan den senare absorberar den, enligt värmeförändringarna som inträffar under kemiska reaktioner.
På liknande sätt kan andra typer av energi involveras i kemiska reaktioner, eftersom ibland under reaktionen, ljusenergi, ljudenergi och till och med elektricitet produceras.
För att ta hänsyn till inte bara värme, utan andra typer av energi, klassificeras kemiska reaktioner som exergonisk och Endermanics. En exergonisk reaktion frigör energi när den produceras, medan en enstegon absorberar den.
I detta fall är en exoterm reaktion också en exergonisk reaktion, eftersom den frigör värmen. Ett av de mest bekanta exemplen är förbränning. Varje gång en bit trä bränns, släpps kalori och ljus energi.
Å andra sidan inträffar en av de bästa kemiska reaktioner som smälter en isbit, eftersom ICE absorberar termisk energi i miljön för att förvandlas till flytande vatten.
En exoterm reaktion kan uppstå spontant, även om du ibland behöver göra lite arbete för att börja. Men för att en endoterm reaktion ska inträffa är det alltid nödvändigt för miljön att göra ett jobb på systemet.
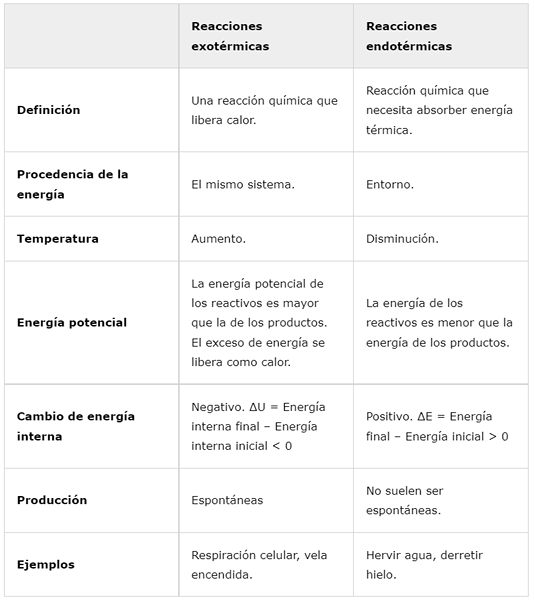
Exotermiska reaktioner | Endotermiska reaktioner | |
Definition | En kemisk reaktion som frigör värmen. | Kemisk reaktion som måste absorbera termisk energi. |
Energin | Samma system. | Runt. |
Temperatur | Öka. | Minska. |
Potentiell energi | Reagensens potentiella energi är större än produkterna. Överskott av energi släpps som värme. | Reagensens energi är mindre än produkternas energi. |
Intern energiförändring | Negativ. ΔU = slutlig intern energi - initial inre energi < 0 | Positiv. ΔE = slutlig energi - initial energi> 0 |
Produktion | Spontan | De är vanligtvis inte spontana. |
Exempel | Cellulär andning, brinnande ljus. | Koka vatten, smälta is. |
Exotermiska reaktioner
Definition
Typ av kemisk reaktion som frigör värmen när den utförs.
Det kan tjäna dig: Cyclohexen: Struktur, egenskaper, syntes och användningarEnergin
Samma system ger energi så att reaktionen inträffar.
Temperatur
Efter reaktionen finns en öka av temperaturen.
Potentiell energi
När en kemisk reaktion inträffar mellan reagensen bryts länkar mellan dem och andra bildas för att skapa nya molekyler. Men inte alla länkar förenar atomer och molekyler med samma kraft, därför är energi att bryta eller skapa varje länk annorlunda.
Under varje reaktion bryter de och skapar olika antal länkar, så energi är annorlunda. I en exoterm reaktion, reagensens potentiella energi är äldre än produkterna, och eftersom energin bevaras släpps överskottet som värme.
Intern energiförändring
Intern energi är relaterad till systemets förmåga att utföra arbete och inkluderar dess potentiella energi och kinetiska energi. Systemets absoluta energi bestäms inte, men dess variation, kallad ΔU.
Enligt vad som sades i föregående avsnitt är förändringen av intern energi ΔU negativ.
ΔU = slutlig intern energi - initial inre energi < 0
Produktion
De flesta exoterma reaktioner är spontan, Det vill säga de äger rum för sig själva utan att behöva lägga till extern energi tills reagensen är uttömda.
Exempel
Normalt är oxidationsreaktioner och de som leder till sammansatt bildning vanligtvis exotermiska reaktioner:
1. Lös tvättmedel i vatten
När han löser kläddamm i lite kallt vatten känner han sig varm när han rör vid det.
2. Cellandning
Hos djur och växter utförs cellulär andningsprocess som en del av kolcykeln. Andning använder glukos och syre för att returnera koldioxid, vatten och energi, enligt reaktionen:
Kan tjäna dig: titanoxid (iv): struktur, egenskaper, användningarC6H12ANTINGEN6 + Sjätte2 → 6co2 + H2O + Energi (ATP)
3. Ett brinnande ljus
Förutom ljus avger ett brinnande ljus värme och andra ämnen:
Syre syre → vatten + koldioxid + ljus och värme
4. Bomben
Detta insekt försvarar sig genom att strö en aerosol om dess rovdjur. Beetle håller vätskor och enzymer i separata fack, belägna i buken.
När den hotas utvisar den vätskorna mot enzymfacket och en kemisk reaktion som genererar ånga och värme produceras och fungerar som avvisande för möjliga rovdjur.
5. Stål- och vinäger
En metallliknande järn oxideras långsamt när man reagerar med miljön, men om vinäger läggs till en liten stålull, observeras att oxidation är mycket snabbare och samtidigt genererar värme.
Endotermiska reaktioner
Definition
Reaktioner där reagens måste absorbera termisk energi så att produkterna erhålls.
Energin
Den energi som krävs för att reaktionen ska genomföras intäkter från miljön.
Temperatur
Den endotermiska reaktionen innebär en minska av temperaturen.
Potentiell energi
Till skillnad från vad som händer med en exoterm reaktion, reagensens energi Det är mindre att produkternas energi.
Intern energiförändring
I en endoterm reaktion är förändringen av intern energi ΔE positiv.
ΔE = slutlig energi - initial energi> 0
Därför är den slutliga energin större än den första.
Produktion
Endotermiska reaktioner kräver att arbetet med systemet görs, så de är vanligtvis inte spontana.
Det finns emellertid några endotermiska reaktioner, såsom smältning av is och förångning av vissa vätskor, som är spontana vid rumstemperatur.
Det dras då att temperaturen i miljön är en avgörande faktor i spontaniteten hos en kemisk reaktion.
Det kan tjäna dig: kemiska indikatorer: vad är de för, typer, exempelExempel
Många av reaktionerna som involverar salter upplösning och i allmänhet är substansnedbrytning vanligtvis endotermiska. På samma sätt är passagen av is till flytande vatten och ångvätskevatten, det vill säga tillståndet omvandlingar, är också endotermiska reaktioner.
1. Fotosyntes
Växterna genomför en kemisk reaktion i närvaro av solljus, där de omvandlar koldioxid och vatten till glukos och syre. Klorofyll är nyckelmolekylen i denna process, vars kemiska reaktion är:
Ljus + 6co2 + H2O → C6H12ANTINGEN6 + Sjätte2
Som man kan se är det den omvända reaktionen av andningen. För att producera ett kilo glukos behövs 15 mega joules av solenergi.
2. Koka vatten och koka
En mycket vanlig reaktion, som kräver energi att fortsätta, är kokande vatten:
H2O (vätska) + energi → h2O (ånga)
Livsmedel kräver normalt vatten för matlagning, och på samma sätt måste vattnet de innehåller avdunsta för att laga dem, vilket innebär en förändring av tillstånd.
3. Att smälta isen
På liknande sätt är det vanligt att is smälter vid rumstemperatur, om detta är större än 0 ° C:
H2O (fast) + energi → h2O (vätska)
Därför svalnar drinken när du lägger till is, eftersom den absorberar den energi som krävs för att ändra tillstånd från vätskan.
4. Kallsäckar
De används för att behandla blåmärken och slag. Innehålla vatten och ett kuvert med ammoniumklorid. När du tappar påsen bryts kuvertet och reaktionen av ammoniumklorid med vatten, som är endoterm, kyler påsen och lindrar smärta.
5. Ozonproduktion
Ultraviolett strålning från solen förvandlar syre till ozon och släpper värme i processen.
3: e2 (gas) + ultraviolett ljus → 2: a3 (gas)
Referenser
- Byju. Skillnaden mellan edotermiska och exotermiska reaktioner. Återhämtat sig från byju.com
- Chang, R. (2013). Kemi. 11VA. Utgåva. McGraw Hill Education.
- Grel. Exoterma reaktioner på värme saker. Återhämtat sig från: Grelane.com.
- Hein, m. (2014). Grunder för högskolekemi. Wiley.
- Helmestine, a. Förstå endotermiska och exotermiska reaktioner. Återhämtat sig från: tankco.com

