Kemiska reaktioner Egenskaper, delar, typer, exempel

- 1007
- 293
- Per Eriksson
De kemiska reaktioner Det är förändringar som är viktiga vid beställningen av sina atomer och äger rum när två olika ämnen eller föreningar kommer i kontakt. I processen ändras som kan uppfattas omedelbart; till exempel en ökning av temperatur, kylning, gasbildning, blinkar eller nederbörd av ett fast ämne.
De vanligaste kemiska reaktionerna går ofta obemärkt i det dagliga livet; Tusentals av dem utförs i våra kroppar. Andra är emellertid mer synliga, eftersom vi kan utföra dem i köket genom att välja korrekta redskap och ingredienser; Blanda till exempel bikarbonat med vinäger, meltersocker i vatten eller försäkra Colorads juice.
 Reaktionen av bikarbonat och vinäger är ett exempel på återkommande kemisk reaktion i köket. Källa: Kate Ter Har (https: // www.Flickr.com/foton/Katerha/5703151566)
Reaktionen av bikarbonat och vinäger är ett exempel på återkommande kemisk reaktion i köket. Källa: Kate Ter Har (https: // www.Flickr.com/foton/Katerha/5703151566) I laboratorier blir kemiska reaktioner mer vanliga och vanliga; Alla förekommer inuti bägare (bägare) eller Erlenmeyer -kolvar. Om de delar gemensamt är ingen enkel, eftersom de döljer kollisioner, länkbrott, mekanismer, länkbildning, energi och kinetiska aspekter.
Det finns kemiska reaktioner så slående att fans och forskare, som känner till toxikologin för reagens och vissa säkerhetsåtgärder, reproducerar dem i stora skalor i fascinerande demonstrationslag.
[TOC]
Kemisk reaktionskoncept
Kemiska reaktioner äger rum när det bryts av en länk (jonisk eller kovalent), så att en annan bildas på plats; Två atomer eller en uppsättning av dem slutar interagera starkt för att orsaka nya molekyler. Tack vare detta kan de kemiska egenskaperna hos en förening, dess reaktivitet, stabilitet, med vad den reagerar kan bestämmas.
Förutom att de är ansvariga de kemiska reaktionerna som saken ständigt förvandlar, utan deras atomer, förklarar de uppkomsten av föreningarna som vi känner dem.
För att länkarna ska brytas krävs energi, och när länkarna bildas släpps den. Om den absorberade energin är större än den som frigörs, sägs det att reaktionen är endotermisk; Vi har en omgivande kylning. Även om värmen som släpps är överlägsen den absorberande, kommer det att vara en exoterm reaktion; Omgivningarna värms upp.
Egenskaper för kemiska reaktioner
Kinetik
Teorinmolekylerna måste samarbeta med varandra och bära med sig tillräckligt med kinetisk energi för att gynna en länk. Om dina kollisioner är långsamma eller ineffektiva påverkas den kemiska reaktionen kinetiskt. Detta kan hända antingen av de fysiska tillstånden i ämnena, eller av geometri eller strukturen av samma.
I en reaktion förvandlas således saken genom att absorbera eller släppa värme, samtidigt som de lider kollisioner som gynnar bildningen av produkter; De viktigaste komponenterna i alla kemiska reaktioner.
Massbevarande
På grund av massbesparingslagen förblir den totala massan av uppsättningen konstant efter en kemisk reaktion. Således är summan av de enskilda massorna för varje ämne lika med den erhållna massan.
Fysiska förändringar och/eller tillståndsförändringar
Förekomsten av en kemisk reaktion kan åtföljas av en förändring av tillståndet för komponenterna; det vill säga en variation i materialets fasta, flytande eller gasformiga tillstånd.
Men inte alla förändringar i tillstånd innebär en kemisk reaktion. Till exempel: Om vattnet förångas på grund av värme förblir den vattenånga som produceras efter denna tillståndsbyte vatten vatten.
Färgvariation
Bland de fysiska attributen som är resultatet av en kemisk reaktion, sticker förändringen i reagensens färg kontra färgen på slutprodukten.
Detta fenomen är märkbart när man observerar den kemiska reaktionen av metaller med syre: när en metall oxideras, ändrar den sin karakteristiska färg (guld eller silver, i förekommande fall), för att bli en orange-rödaktig ton, känd som rost.
Gasutsläpp
Denna egenskap manifesteras som en bubblande eller med utsläpp av särskild lukt.
I allmänhet förekommer bubblor som ett resultat av inlämnande av en vätska vid höga temperaturer, vilket uppmuntrar en ökning av kinetisk energi hos molekylerna som är en del av reaktionen.
Temperaturförändringar
I händelse av att värme är en katalysator av den kemiska reaktionen kommer en temperaturförändring att induceras i slutprodukten. Därför kan värmeinmatning och utgång i processen också vara ett kännetecken för kemiska reaktioner.
Delar av en kemisk reaktion
Reagens och produkter
En kemisk reaktion representeras av en ekvation av typen:
A + B → C + D
Där A och B är reaktanterna, medan C och D produkterna. Ekvationen berättar att atomen eller molekylen A reagerar med B för att orsaka produkter C och D. Detta är en irreversibel reaktion, eftersom reaktanter inte kan komma från produkterna. Istället är reaktionen nedan vändbar:
A + B C + D
Det är viktigt att betona att massan av reaktanterna (A+B) måste vara lika med massan på produkterna (C+D). Annars skulle degen inte bevaras. På samma sätt måste antalet atomer för ett givet element vara detsamma före och efter pilen.
Ovanför pilen indikerar vissa specifikationer för reaktionen: temperaturen (Δ), förekomsten av ultraviolett strålning (Hv) eller den katalysator som används.
Kan servera dig: klockglasReaktionsmedel
När det gäller liv och reaktioner som förekommer i våra kroppar är reaktionsmediet vattenhaltigt (AC). Kemiska reaktioner kan emellertid utvecklas i vilket flytande medium (etanol, glacial ättiksyra, toluen, tetrahydrofuran, etc.) så länge reagensen är väl upplösta.
Containrar eller reaktorer
Kontrollerade kemiska reaktioner förekommer i en behållare, vare sig det är ett enkelt glasmaterial eller i en rostfritt stålreaktor.
Typer av kemiska reaktioner
Typerna av kemiska reaktioner är baserade på vad som händer på molekylnivå; Vilka länkar går sönder och hur atomerna slutar gå med. Det beaktas också om arter får eller förlorar elektroner; Även när detta inträffar i de flesta kemiska reaktioner.
Här är de olika typerna av kemiska reaktioner som finns.
- Oxidationsminskning (Rédox)
Kopparoxidation
I exemplet med patina sker en oxidationsreaktion: Metall koppar förlorar elektroner i närvaro av syre för att förvandlas till dess motsvarande oxid.
4CU (S) + O2(g) => cu2Du)
Kopparoxid (I) fortsätter att oxidera för att ge kopparoxid (II):
2CU2Eller (S) + eller2 => 4CUO (S)
Denna typ av kemisk reaktion där arter ökar eller minskar deras oxidationsnummer (eller status) är känd som oxidation och reduktionsreaktion (Rédox).
Metallisk koppar med oxidationstillstånd 0, förlorar först en elektron, och sedan den andra (oxiderar), medan syre kvarstår (det reduceras):
Cu => cu+ + och-
Cu+ => Cu2+ + och-
ANTINGEN2 + 2e- => 2: a2-
Förstärkning eller förlust av elektroner kan bestämmas genom att beräkna oxidationsnummer för atomer i de kemiska formlerna för deras resulterande föreningar.
För cu2Eller det är känt att eftersom det är en oxid har den anjon eller2-, Så för att hålla de neutraliserade belastningarna måste var och en av de två kopparatomerna ha +1 belastning. Mycket liknande förekommer med Cuo.
Koppar vid oxiderad förvärvar positiva oxidationsnummer; och syre, som ska reduceras, negativa oxidationsnummer.
Järn och kobolt
Ytterligare exempel för reaktioner visas nedan. På samma sätt kommer en kort kommentar att göras och ändringar i oxidationsnummer kommer att anges.
Fecl2 + Cocl3 => Fecl3 + Cocl2
Om oxidationsnummer beräknas kommer det att noteras att de för CL förblir med ett konstant värde av -1; Inte så, med de av tro och co.
Vid första anblicken har järn oxiderat medan kobolt har minskat. Hur man vet? Eftersom järn interagerar nu inte med två cl- men med tre, att vara den mest elektronegativa kloratomen än järn och kobolt. Å andra sidan händer det motsatta med kobolt: det går från att interagera med tre cl- till två av dem.
Om det föregående resonemanget inte är klart skrivs de kemiska ekvationerna för nettoöverföring av elektroner:
Tro2+ => Tro3+ + och-
Co3+ + och- => Co2+
Därför tro2+ Det oxiderar, medan CO3+ är nedsatt.
Jod och mangan
6 kmno4 + 5Ki + 18HCl => 6MNCL2 + 5KIO3 + 6kcl+ 9h2ANTINGEN
Ovanstående kemikalie kan verka komplicerad, men det är det inte. Klor (Cl-) inte syre (eller2-) uppleva vinst eller förlust av sina elektroner. Jod och mangan, ja.
Med tanke på bara föreningar med jod och mangan du har:
Ki => kio3 (Oxidationsnummer: -1 till +5, förlorar sex elektroner)
Kmno4 => Mcl2 (Oxidationsnummer: +7 till +2, vinner fem elektroner)
Jod oxiderar, medan mangan är reducerad. Hur man vet utan att beräkna? Eftersom jod går från att vara med kalium för att interagera med tre syre (mer elektronegativa); Och mangan förlorar under tiden interaktioner med syre för att vara med klor (mindre elektronegativ).
Ki kan inte förlora sex elektroner om KMNO4 Vinn fem; Det är därför antalet elektroner måste balanseras i ekvationen:
5 (ki => kio3 + 6e-)
6 (kmno4 + 5e- => Mcl2)
Vilket ger upphov till en nettoöverföring av 30 elektroner.
Förbränning
Förbränning är en kraftfull och energisk oxidation där ljus och värme släpps. I denna typ av kemisk reaktion deltar syre i allmänhet som ett oxiderande eller kombinerande medel; Medan reducerande agent är bränslet, som brinner i slutet av kontot.
Där det finns aska var det förbränning. Dessa består av kol- och metalloxider; Även om dess sammansättning logiskt beror på vad bränslet var. Nedan följer några exempel:
C (s) + o2(g) => co2(g)
2co (g) + eller2(g) => 2co2(g)
C3H8(g) + 5o2(g) => 3co2(g) + 4h2O (g)
Var och en av dessa ekvationer motsvarar fullständiga förbränningar; Det vill säga allt bränslet reagerar med ett överskott av syre för att garantera dess fullständiga omvandling.
Det bör också noteras att CO2 och h2Eller så är de gasformiga majoritetsprodukter när kolsyrade kroppar bränner (som trä, kolväten och djurvävnader). Det är oundvikligt att vissa kolalotropiska bildas på grund av en syreinsufficiens, såväl som mindre syresatta gaser som CO och inte.
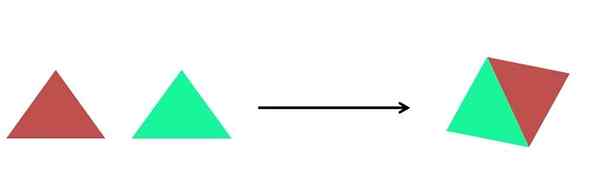
- Syntes
 Grafisk representation av en syntesreaktion. Källa: Gabriel Bolívar.
Grafisk representation av en syntesreaktion. Källa: Gabriel Bolívar. I den överlägsna bilden visas en mycket enkel representation. Varje triangel är en förening eller atom, som samlas för att bilda en enda förening; Två trianglar bildar ett parallellogram. Massorna ökar och produktens fysiska och kemiska egenskaper skiljer sig ofta mycket från deras reagens.
Kan tjäna dig: entalpiTill exempel producerar förbränning av väte (som också är en Rédox -reaktion) väteoxid eller syrehydrid; Bättre känd som Agua:
H2(g) + eller2(g) => 2h2O (g)
Genom att blanda båda gaserna, vid en hög temperatur, bränna producerande gasformigt vatten. Kylda temperaturer, ångor kondenserar för att ge flytande vatten. Flera författare betraktar denna syntesreaktion som ett av de möjliga alternativen för att ersätta fossila bränslen för att få energi.
H-H och O = O-länkar bryts för att bilda två nya enkla länkar: H-O-H. Vatten är, som är välkänt, ett oöverträffat ämne (utöver romantisk mening), och dess egenskaper skiljer sig mycket från gasformigt väte och syre.
Joniska föreningar
Bildningen av joniska föreningar från dess element är också ett exempel på en syntesreaktion. En av de enklaste är bildningen av metallhalgenuros i grupperna 1 och 2. Till exempel syntesen av kalciumbromid:
Ca (s) + br2(L) => Cabr2(S)
En allmän ekvation för denna typ av syntes är:
M (s) + x2 => Mx2(S)
Samordning
När föreningen bildas involverar en metallatom inom elektronisk geometri, sägs det att det är ett komplex. I komplex förblir metaller förenade med ligand av svaga kovalenta bindningar och bildas genom koordinationsreaktioner.
Till exempel har du komplexet [CR (NH3)6]3+. Detta bildas när Cration3+ är i närvaro av ammoniakmolekyler, NH3, som fungerar som kromligander:
Cr3+ + 6 NH3 => [Cr (NH3)6]3+
Nedan är den resulterande koordinationen Octahedron runt Chrome Metal Center:
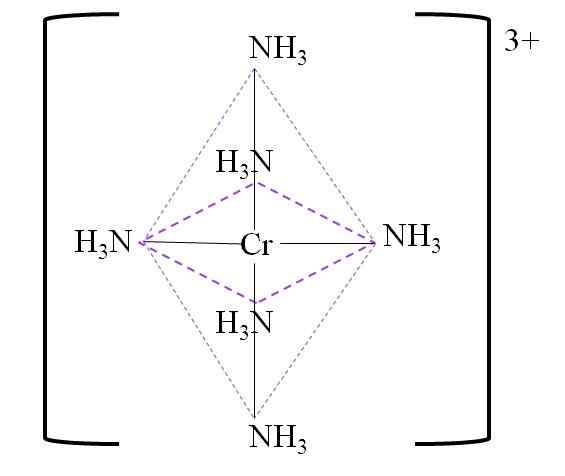 Koordination Octahedron för komplexet. Källa: Gabriel Bolívar.
Koordination Octahedron för komplexet. Källa: Gabriel Bolívar. Observera att krom 3+ belastning inte neutraliseras i komplexet. Dess färg är lila, och det är därför oktaedronen representeras med nämnda färg.
Vissa komplex är mer intressanta, som för vissa enzymer som koordinerar järn-, zink- och kalciumatomer.
- Sönderfall
Nedbrytning blir motsatsen till syntes: En förening bryts in i ett, två eller tre element eller föreningar.
Till exempel finns det följande tre nedbrytningar:
2hgo (s) => 2Hg (l) + o2(g)
2h2ANTINGEN2(L) => 2h2Eller L) + O2(g)
H2Co3(ac) => co2(g) + h2Eller (l)
Hgo är ett rödaktigt fast ämne som genom värmeverkan bryts in i metall kvicksilver, svart vätska och syre.
Väte väteperoxid lider av nedbrytning, vilket ger flytande vatten och syre.
Och kolsyra sönderdelas under tiden i koldioxid och flytande vatten.
En mer "torr" nedbrytning är den som lidit av metallkarbonater:
Tjuv3(s) => cao (s) + co2(g)
Vulkan
 Möbler ammoniumdikromat vulkan. Källa: наталия [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]
Möbler ammoniumdikromat vulkan. Källa: наталия [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] En nedbrytningsreaktion som har använts i kemiklasser är den termiska nedbrytningen av ammoniumdikromat, (NH4)2Cr2ANTINGEN7. Detta orange karcanogenala salt (så det bör hanteras med stor omsorg), brännskador för att frigöra mycket värme och producera en grön fast, kromisk oxid, CR2ANTINGEN3:
(NH4)2Cr2ANTINGEN7(s) => cr2ANTINGEN3(S) + 4H2Eller (g) + n2(g)
- Förflyttning
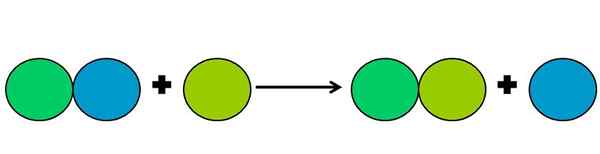 Grafisk representation av en förskjutningsreaktion. Källa: Gabriel Bolívar.
Grafisk representation av en förskjutningsreaktion. Källa: Gabriel Bolívar. Förskjutningsreaktioner är en typ av reaktion Rédox där ett element förskjuter ett annat i en förening. Det fördrivna elementet hamnar med att minska eller vinna elektroner.
För att förenkla ovanstående visas den övre bilden. Cirklar representerar ett element. Det observeras att Lima Green Circle förskjuter den blå och är på utsidan; Men inte bara det, utan den blå cirkeln reduceras i processen, och den hos Green Lima oxideras.
Väte
Till exempel följande kemiska ekvationer för att exponera ovanstående:
2Al (S) + 6HCL (AC) => ALCL3(AC) + 3H2(g)
Zr (s) + 2h2Eller (g) => zro2(S) + 2H2(g)
Zn (s) + h2Sw4(ac) => znso4(Ac) + h2(g)
Vad är det fördrivna elementet för dessa tre kemiska reaktioner? Väte, som reduceras till molekylärt väte, h2; passerar från ett oxidationsnummer +1 till 0. Observera att aluminium-, zirkon- och zinkmetaller kan förskjuta hydrogener av syror och vatten; Medan koppar, silver eller guld kan inte.
Metaller och halogen
På samma sätt är dessa ytterligare två förskjutningsreaktioner tillgängliga:
Zn (s) + cuo4(ac) => cu (s) + znso4(Ac)
Kli2(g) + 2nai (AC) => 2NACL (AC) + i2(S)
I den första reaktionen förskjuter zink den mindre aktiva metall koppar; Zink oxiderar medan koppar reduceras.
I den andra reaktionen, å andra sidan, klor, mer reaktivt element än jod, förskjuter det senare i natriumsalt. Här inträffar bakåt: det mest reaktiva elementet reduceras genom att oxidera det fördrivna elementet; Därför reduceras klor till jod.
- Gasbildning
I reaktionerna kunde man se att flera av dem genererade gaser, och därför kommer de också in i denna typ av kemisk reaktion. På samma sätt betraktas reaktionerna från föregående avsnitt, väteförskjutningen med en aktiv metall, gasbildning reaktioner.
Kan tjäna dig: Dodecil natriumsulfat (SDS): Struktur, egenskaper, användningarFörutom de som redan nämnts släpper metallsulfider, till exempel, vätesulfid (som luktar ruttna ägg) när saltsyra tillsätts:
Na2S (S) + 2HCl (AC) => 2NACL (AC) + H2S (g)
- Metahesis eller dubbelförskjutning
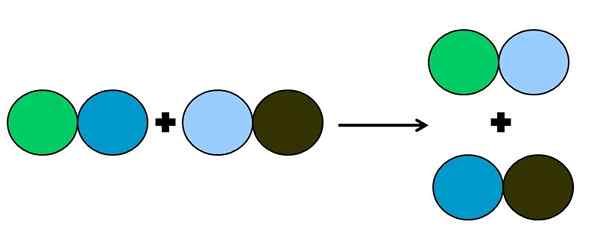 Grafisk representation av en dubbel förskjutningsreaktion. Källa: Gabriel Bolívar.
Grafisk representation av en dubbel förskjutningsreaktion. Källa: Gabriel Bolívar. I reaktionen av metates eller dubbelförskjutning är det som händer en förändring av par utan elektronöverföringar; det vill säga, det betraktas inte som en reaktion Rédox. Som framgår av den överlägsna bilden bryter Green Circle länken med den för mörkblå för att länka till den ljusblå cirkeln.
Nederbörd
När interaktioner mellan ett av paren är tillräckligt starka för att övervinna vätskeslösningseffekten, erhålls en fällning. Följande kemiska ekvationer representerar nederbördsreaktioner:
Agno3(AC) + NaCl (AC) => AGCL (S) + Nano3(Ac)
CaCl2(Ac) + na2Co3(ac) => caco3(S) + 2NACL (AC)
I den första reaktionen CL- förskjuter nr3- För att bilda silverklorid, AGCL, som är en vit fällning. Och i den andra reaktionen, CO32- förskjuter cl- För att fälla ut kalciumkarbonat.
Bassyra
Det kanske mest emblematiska för metatesreaktioner är den för neutraliseringsbassyra. Slutligen visas två bassyrreaktioner som exempel:
HCl (AC) + NaOH (AC) => NaCl (AC) + H2Eller (l)
2HCl (AC) + BA (OH)2(Ac) => bacl2(AC) + 2H2Eller (l)
ÅH- De flyttar till CL- För att bilda vatten och kloridsalter.
Exempel på kemiska reaktioner
Nedan och då kommer det att nämnas några kemiska reaktioner med deras respektive ekvationer och kommentarer.
Förflyttning
Zn (s) + agno3(AC) → 2AG (S) + Zn (Nej3)2(Ac)
Zink förskjuter silver i sitt nitratsalt: det minskar Ag+ En ag. Som ett resultat börjar metallsilver att fälla ut i mitten, observeras vid ett mikroskop som silverfria träd. Å andra sidan kombineras nitrat med Zn -joner2+ vilket resulterar i att bilda zinknitrat.
Neutralisering
Tjuv3(S) + 2HCl (AC) → CaCl2(Ac) + h2Eller (l) + co2(g)
Saltsyra neutraliserar kalciumkarbonatsalt för att producera salt, kalciumklorid, vatten och koldioxid. Kompaniet2 bubblor och upptäcks i vattnet. Denna bubb3.
Nh3(g) + HCl (G) → NH4Cl (s)
I den andra reaktionen neutraliserar HCls den gasformiga ammoniak. Salt ammoniumkloriden, NH4CL, är bildad som en vitaktig rök (lägre bild), eftersom den innehåller mycket fina partiklar suspenderade i luften.
 Ammoniumkloridträningsreaktion. Källa: Adam Rędzikowski [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]
Ammoniumkloridträningsreaktion. Källa: Adam Rędzikowski [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] Dubbelförskjutning
Agno3(AC) + NaCl (AC) → AGCL (S) + Nano3(Ac)
I en dubbelförskjutningsreaktion finns det ett utbyte av "par". Silver byter ett par med natrium. Resultatet är att det nya saltet, silverklorid, AGCL, fälls ut som ett mjölkigt fast ämne.
Rédox
 I den kemiska reaktionen släpps skällande hundvärme, ljud och blått ljus. Källa: Maxim Bilovitskiy via Wikipedia.
I den kemiska reaktionen släpps skällande hundvärme, ljud och blått ljus. Källa: Maxim Bilovitskiy via Wikipedia. Det finns otaliga reaktioner Rédox. En av de mest imponerande är Barkin Dog:
8 n2Eller (g) + 4 cs2(L) → s8(s) + 4 co2(g) + 8 n2(g)
Energin som släpps är så mycket när de tre stabila produkterna bildas, att en blåaktig blixt (överlägsen bild) och en rungande ökning av trycket orsakat av gaserna har sitt ursprung (co2 och n2).
Och dessutom åtföljs allt detta av ett mycket starkt ljud som liknar en hunds skällande. Svavelproducerad, s8, Täck gul de inre väggarna i röret.
Vilken art reduceras och vilken oxideras? Som en allmän regel har elementen oxidationsnummer 0. Därför måste svavel och kväve i produkter vara de arter som fick eller förlorade elektroner.
Svavel oxiderad (förlorade elektroner), eftersom den hade oxidationsnummer -2 i CS2 (C4+S22-):
S2- → s0 + 2e-
Medan kväve minskades (vann elektroner), eftersom det hade oxidationsnummer +1 i N2Eller (n2+ANTINGEN2-):
2n+ + 2e → n0
Löst kemiska reaktioner övningar
- Övning 1
Vad salt fälls ut i nästa reaktion i vattenhaltigt medium?
Na2S (ac) + feso4(AC) →?
Som en allmän regel fälls alla sulfider, med undantag för bildade med alkaliska och ammoniummetaller i vattenhaltigt medium. En dubbelförskjutning inträffar: järn binder till sulfid och natrium med sulfat:
Na2S (ac) + feso4(AC) → FES (S) + NA2Sw4(Ac)
- Övning 2
Vilka produkter får vi från följande reaktion?
Stämpel3)2 + Ca (oh)2 →?
Kalciumhydroxid är inte särskilt löslig i vatten; Men tillsatsen av kopparnitrat hjälper till att solubilisera det eftersom det reagerar för att bilda dess motsvarande hydroxid:
Stämpel3)2(AC) + CA (OH)2(AC) → CU (OH)2(S) + CA (nej3)2(Ac)
CU (OH)2 Det är direkt igen för att vara en blå fällning.
- Övning 3
Vilket salt kommer att inträffa i nästa neutraliseringsreaktion?
Al (OH)3(S) + 3HCl (AC) → ¿¿?
Aluminiumhydroxid uppför sig som en bas som reagerar med saltsyra. I en reaktion av syra-basneutralisering (från Brnsted-Lowry) bildas alltid vatten, så den andra produkten måste vara aluminiumklorid, ALCL3:
Al (OH)3(S) + 3HCl (AC) → ALLL3(AC) + 3H2ANTINGEN
Den här gången ALCL3 Det fälls inte ut eftersom det är ett salt (till viss del) lösligt i vatten.
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan.). Cengage Learning.
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Ana zita. (18 november 2019). Kemiska reaktioner. Återhämtat sig från: Todamateria.com
- Kashyap vyas. (23 januari 2018). 19 coola kemiska reaktioner som Prov Science är falcinerande. Återhämtat sig från: intressant ingå.com
- Vackerkemi.net (s.F.). Reaktion. Återhämtat sig från: BeautifulChemistry.netto
- Wikipedia. (2019). Kemisk reaktion. Hämtad från: i.Wikipedia.org

