Sjunkningsregel eller maximal mångfald

- 1388
- 334
- Anders Larsson
Vi förklarar vad HUND -regeln eller principen om maximal mångfald är, steg för att tillämpa den och ge flera exempel
 Källa: Gabriel Bolívar
Källa: Gabriel Bolívar Vad är diskbänksregeln?
De Sjunkande regel, Även kallad maximal multiplicitetsprincip för spin, det är en empirisk regel som används för att skriva den absoluta elektroniska konfigurationen av de kemiska elementen när de är i deras grundläggande tillstånd. Det vill säga, det är en regel som hjälper till att förutsäga hur elektroner distribueras i atomiska orbitaler i en atom som är avslappnad eller på sin lägsta energinivå.
Sinks regel säger:
"... I en atom som är i dess grundläggande tillstånd kommer elektroner av samma energinivå att fördelas på ett sådant sätt att det är så mycket som möjligt av parallella ryggar".
Denna regel motsvarar en av de grundläggande principerna för kvantmekanik och aktuell atomteori. Det är mycket användbart att förstå vissa egenskaper hos de olika elementen, särskilt deras magnetiska egenskaper. Detta beror på att atomer lockas eller avvisas av magneter eftersom de har försvunnit elektroner i sin struktur.
Var kommer diskbänken eller maximal multiplikationsregeln ifrån?
Atomspektra
Denna princip uttalade först den tyska fysikern Friedrich Hund 1927. Sänk studerade atomabsorptionsspektra, som tillåter experimentellt mäta den energi som elektroner absorberar när de utsätts för elektromagnetisk strålning av adekvat våglängd. Experimentella observationer kunde bara förklaras om atomen hade så mycket elektroner som möjligt med samma snurr.
Saknade elektroner
Förutom atomspektra finns det andra experimentella observationer som bekräftar de elektroniska konfigurationerna som förutsägs genom att tillämpa HUND -regeln. Det viktigaste består av de experimentella måtten för de magnetiska egenskaperna hos atomer som gör det möjligt att bestämma hur många saknade elektroner som har en atom.
Det kan tjäna dig: vattenelektrolysDe saknade elektronerna är de som är ensamma i en orbital, utan deras respektive motsatta spinnpar.
Steg för att tillämpa diskbänksregeln
Sänkregeln gäller när vi skriver den elektroniska konfigurationen av en atom i dess grundläggande tillstånd. Detta innebär att det är en kompletterande regel för andra regler, till exempel Aufbau -principen eller konstruktionsprincipen (även kallad regnregeln) och principen om uteslutning av Pauli.
Gäller endast de fall där vi vill.
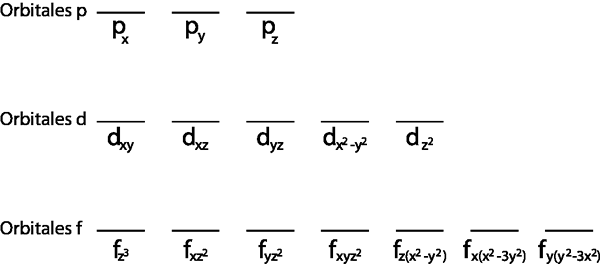
Dessutom är det bara vettigt att tillämpa det för Valencia -lagret, det vill säga den energinivån som är ofullständig (den har inte alla elektroner som passar in i det). Annars skulle alla elektroner kopplas ihop för att följa Paulis uteslutningsprincip.
Tillämpningen av denna regel består av följande steg:
- Steg 1: Rita en horisontell linje eller en liten rektangel för varje omlopp för undernivån.
- Steg 2: Placera den första elektronen i den första omloppet med din snurrpekande.
- Steg 3: Placera följande elektron i nästa orbital, och påpekar också.
- Steg 4: Fortsätt så här tills elektronerna är över eller det finns inga fler tomma orbitaler.
- Steg 5: Om när du placerar en elektron i varje omlopp finns det fortfarande elektroner som ska distribueras, upprepa steg 2 till 4 men placera elektronerna med sin snurr pekande ner.
För att förstå hur dessa steg gäller, låt oss analysera ett par exempel.
Exempel 1: Kvävelektronisk konfiguration
Kväve är element nummer 7, så det har totalt 7 elektroner som kretsar kring kärnan. Dessa elektroner distribueras enligt följande, efter regnregeln:
Kan tjäna dig: acetanylid (C8H9NO)1s2 2s2 2 p3
Som vi kan se motsvarar kvävevalensskiktet nivå 2 för energi (kallad lager L) där 8 elektroner passar. Kväve har emellertid bara 5 Valencia -elektroner.
I orbitalerna s Endast 2 elektroner passar, så 2s orbital är helt full och har ingen mening att tillämpa diskbänksregeln för denna orbital.
Å andra sidan är 2p -undernivån, som innehåller 3 orbitaler, inte full. Men hur fördelas dessa tre elektroner i dessa tre orbitaler? De distribueras efter stegen i diskbänksregeln, som presenteras nedan:
Steg 1: Rita en horisontell linje eller en liten rektangel för varje omlopp för undernivån.
Eftersom det är 2p -undernivån finns det tre orbitaler som är 2px, 2 poch och 2pz. Så vi måste rita tre horisontella ränder eller tre lådor eller rektanglar:
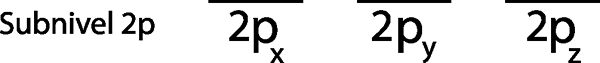
Var och en av dessa ränder eller lådor representerar en orbital, vilket anges i namnet som har ner var och en av dem.
Steg 2: Placera den första elektronen i den första omloppet med din snurrpekande.
Vi placerar den första elektronen i 2p orbitalx Eftersom detta är det första omloppet på listan.
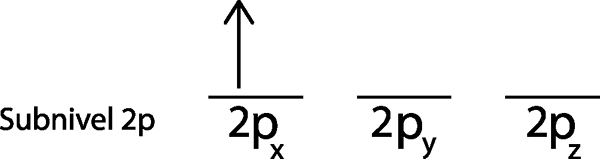
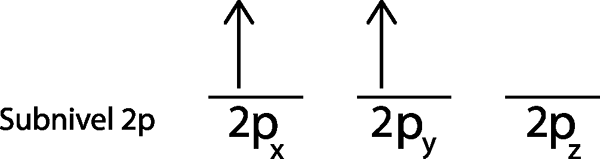
Steg 3: Placera följande elektron i nästa orbital, och påpekar också.
Den andra elektronen ligger i 2p orbitaloch
Steg 4: Fortsätt så här tills elektronerna är över eller det finns inga fler tomma orbitaler.
I vårt fall måste vi bara distribuera 3 elektroner, så vi behöver bara placera den sista elektronen i den sista orbitalen och voila:
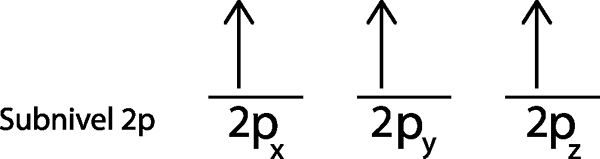
Som man kan se förutspår principen om maximal mångfald eller diskbänk att atomkväve måste ha 3 saknade elektroner.
Kan tjäna dig: kväveoxider (NOx)I det här fallet var det inte nödvändigt att tillämpa steg 5, eftersom vi efter steg 4 lämnades utan elektroner för att distribuera.
Exempel 2: Järnelektronisk konfiguration
Järn är element 26 och dess elektroniska konfiguration är:
1s2 2s2 2 p6 3s2 3p6 3D6 4S2
I det här fallet kan vi notera att omloppet med den högsta energinivån är 4s, men eftersom det är en övergångsmetall har järn en delvis full orbital d. Detta är den omloppsbana vars elektroner vi kommer att distribuera efter den junda regeln.
Steg 1: Rita en horisontell linje eller en liten rektangel för varje omlopp för undernivån.
Vi kommer att fylla 3D -undernivån som innehåller 5 orbitaler:
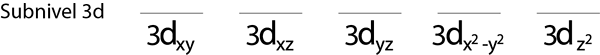
Steg 2: Placera den första elektronen i den första omloppet med din snurrpekande.
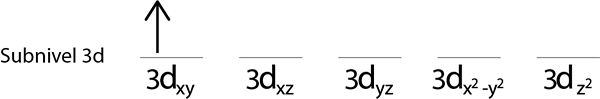
Steg 3: Placera följande elektron i följande orbital och påpekar också.
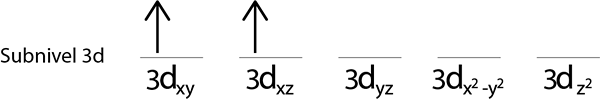
Steg 4: Fortsätt så här tills elektronerna är över eller det finns inga fler tomma orbitaler.
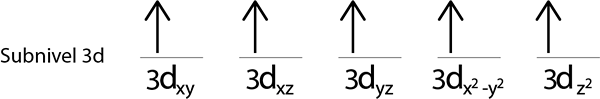
Steg 5: Om när du placerar en elektron i varje omlopp finns det fortfarande elektroner som ska distribueras, upprepa steg 2 till 4 men placera elektronerna med sin snurr pekande ner.
Eftersom vi fortfarande har en elektron att distribuera efter att ha placerat en elektron i varje 3D -orbital, placeras den sista av de 6 elektronerna med motsatt snurr i den första omloppet.
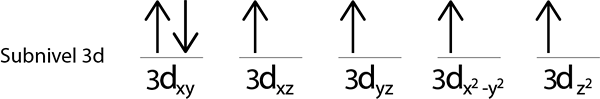
Detta är den absoluta konfigurationen av en järnatom i dess grundläggande tillstånd. På samma sätt har järn 4 saknade elektroner med parallella ryggar.
Referenser
- Utan svarsfrågor om maximal multiplicitet eller diskbänk: vad ska göras (2020). Hämtad från Physis och Quimica.com.
- Sänk - kemi (2021). Hämtad från CostProject.org.
- Maximal multiplicitet av Sind (2020). Hämtad från Principiode.com.
- Sänkregel | Chemistry Guide (2012). Hämtad från kemi.Laguia2000.com.

