Takera -egenskaper, struktur, funktioner
- 3303
- 150
- PhD. Emil Svensson
De Sakera, Även känd som tabera-isomaltaskomplexet är det ett membranalt enzymatiskt komplex med a-glykosylasaktivitet som tillhör gruppen av omfattande hydrolaser (bestående av glykosidaser och peptidaser).
Det är närvarande i tarmmikroovingarna hos många landdjur som däggdjur, fåglar och reptiler. Enligt olika bibliografiska källor är andra accepterade namn på detta enzym oligo-1,6-glukosidas, a-metylglukosidas, isomaltas och oligosackarid a-1,6-glukosidas.
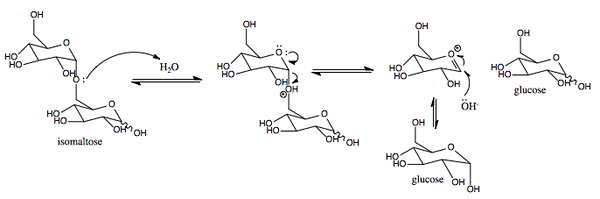
 Grafisk representation av SACAS: s verkningsmekanism.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] via Wikimedia Commons)
Grafisk representation av SACAS: s verkningsmekanism.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] via Wikimedia Commons) Det är ett enzym med aktivitet som liknar inverteringen hittades i växter och mikroorganismer. Dess primära funktion är att hydrolysera den glukosidiska bindningen mellan monosackarider (glukos och fruktos) som utgör sackarosen som intas med mat.
Den har mycket viktiga matsmältningsfunktioner, eftersom sackaros inte kan transporteras som en disackarid i tarmceller och därför tillåter dess hydrolys tarmsabsorptionen av dess beståndsdel monosackarider.
Syntesen och aktiviteten hos stam-isomaltas i tarmcellerna hos djuren regleras på många nivåer: under transkription och översättning, under glykosylering och även under dess post-translationella bearbetning.
När någon av dessa händelser misslyckas eller någon typ av mutation sker i genen som kodar för den, finns det hos människor ett patologiskt tillstånd som kallas sackarosbristsyndromet, som är relaterat till omöjligt att metabolisera disackarider.
[TOC]
Egenskaper
Disackariderna som fungerar som ett substrat för däggdjur hos däggdjur är vanligtvis produkten av den hydrolytiska aktiviteten hos saliv- och bukspottkörtel-a-amylaserenzymer. Detta beror på det faktum att Sacas inte bara hydrolyserar de glukosidiska bindningarna av sackaros, utan också a-1,4-bindningarna i maltosen och maltotriosa och andra oligosackarider.
Halva livet för samma variation mellan 4 och 16 timmar, så tarmceller investerar mycket.
Kan tjäna dig: vad är krenationen? (Biologi)Syntes
Liksom de flesta omfattande hydrolasenzymer är sackwaters (stust-isomaltas eller JA) ett syntetiserat glykoprotein i penselkantceller såsom en polypeptidprekursor som betecknas pro-fi.
Denna föregångsmolekyl transporteras till cellernas apikala yta och det bearbetas enzymatiskt av bukspottkörtelproteaser som delar upp den i två olika underenheter: isomaltasunderenheten och subunidad subunidadadadadadad.
Isomaltas-underenheten motsvarar den terminala aminoänden av pro-SI och har ett hydrofobt segment (hydrofobt ankare) vid dess N-terminala ände. Detta gör att du kan associera med plasmamembranet i tarmceller med penselkant.
Genen som kodar för detta komplex hos människor är belägen i den långa armen av kromosom 3 och med tanke på den stora homologin för sekvens mellan båda underenheterna (mer än 40%) har det föreslagits att detta enzym uppstod genom en genetisk dupliceringshändelse.
Det har bevisats att både underenheter, isomaltas och SACAS, kan hydrolyz.
Strukturera
Den initiala formen av enzymet SACAS, pro-Si-polypeptiden, har cirka 260 kDa och 1827 aminosyror. Emellertid producerar den proteolytiska aktiviteten hos bukspottkörtelproteaser två underenheter på 140 kDa och 120 kDa, som representerar isomaltas respektive sacaras.
Detta enzym är ett glykoprotein med sackariddelar N- och ANTINGEN-Glykosilador och studierna av deras sekvens avslöjar närvaron av mer än 19 glykosyleringsplatser. Kolhydratdelar representerar mer än 15% av proteinets vikt och består i huvudsak av sinalsyra, galaktosamin, hand och N-acetylglukosamin.
Kan tjäna dig: leucin: egenskaper, struktur, funktioner, biosyntesSince the two subunits of the Sacrase-Isomaltase complex are not exactly the same, many authors consider that this enzyme is, in reality, a heterodimer where each subunit consists of a glycosylated linear polypeptide chain and that it is associated through non-covalent links.
Isomaltas -subenheten har ett hydrofobt segment av 20 aminosyravfall som är involverat i dess associering med membranet av enterocyter (tarmceller) och som representerar ett permanent ankare och en peptidsignal för att gå till endoplasmatisk retikulum.
Det aktiva stället för båda underenheterna, SACAS och ISOMALTASE, finns i plasmamembranet i enterocyter, som sticker ut mot tarmlumen.
Funktioner
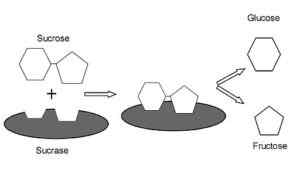
De viktigaste metaboliska funktionerna hos enzymer såsom stipendi-isomaltas är relaterade till produktion av glukos och fruktos från sackaros. Monosackarider som transporteras till tarmceller och som är integrerade i olika metaboliska rutter med olika syften.
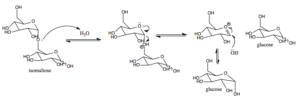 Verkningsmekanism av socker-isomaltas hos däggdjur (källa: ARID3 [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] via Wikimedia Commons)
Verkningsmekanism av socker-isomaltas hos däggdjur (källa: ARID3 [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] via Wikimedia Commons) Glukos, för vilken det finns specifika transportörer, kan riktas intracellulärt mot glykolys, till exempel, där dess oxidation leder till produktion av energi i form av ATP och reducerar kraft i form av NADH.
Fruktos, å andra sidan, kan också metaboliseras av en serie reaktioner som börjar med dess fosforylering för att fruktos 1-fosfat och katalyseras av ett leverfruktokinas. Detta börjar inkluderas av detta underlag till andra energiproduktionsvägar.
Dessutom, som med enzymet inverterat i växter, har socker-isomaltasaktiviteten viktiga konsekvenser i cellulära aspekter såsom osmotiskt tryck, som vanligtvis konditionerar fysiologiska händelser såsom tillväxt, utveckling, transport av molekyler och andra.
Mänskliga relaterade sjukdomar
Det finns en medfödd autosomal sjukdom hos människor som kallas stipendi-isomaltasa eller CSID-brist (engelska Medfödd lindy-isomaltasbrist), som är relaterad till defekter i oligo matsmältning- och osmotiskt aktiva disackarider.
Kan tjäna dig: grundande effektDenna sjukdom har att göra med flera samtidiga faktorer, bland vilka felaktigt åtal för pro-om föregångarformen av enzymet, genetiska mutationer, fel under transport etc.
Detta tillstånd är svårt att diagnostisera, och förväxlas ofta med en laktosintolerans. Därför är det också känt som "sackarosintolerans".
Det kännetecknas av utvecklingen av magkramper, diarré, kräkningar, Jaquecas åtföljd av hypoglykemi, brist på tillväxt och viktökning, ångest och överdriven produktion av gaser.
Referenser
- Brunner, J., Hauser, h., Braun, h., Wilson, K., Wecker, w., O'Neill, f., & Semenza, g. (1979). Associeringssättet för enzymkomplexet lygas-isomaltas med tarmborstens gränsmembran. Journal of Biologic Chemistry, 254(6), 1821-1828.
- Cowell, g., Tranum-jensen, j., Sjöström, h., & Norén, eller. (1986). Topologi och kvartärstruktur av pro-sucrase / isomaltas och slutformad simerad / isomaltas. Journalbiokemisk, 237, 455-461.
- Hauser, h., & Semenza, g. (1983). Limade-isomaltas: Ett stjälkat intrinsiskt protein från borstgränsmembranet. Kritiska recensioner i Bioch, 14(4), 319-345.
- Hunziker, w., Spiesss, m., Semenza, g., & Lodish, h. F. (1986). Limade-Lsomaltaskomplexet: primär struktur, membranorientering och utveckling av en stjälkad, inneboende borstgränsprotein. Cell, 46, 227-234.
- Naim, h. OCH., Roth, j., Sterchi, e. OCH., Lentze, m., Mil, s., Schmitz, j., & Hauril, h. (1988). Lind-isomaltasbrist hos människor. J. Klinka. Investera., 82, 667-679.
- Rodriguez, jag. R., Taravel, f. R., & Whelan, W. J. (1984). Karakterisering och funktion av gris tarm Linde-isomaltas och dess separata underenheter. Eur. J. Biokemi., 143, 575-582.
- Schiweck, h., Clarke, m., & Pollach, g. (2012). Socker. I Ullmanns Encyclopedia of Industrial Chemistry (Vol. 34, s. 72). Wiley-VCH Verlag GmbH & Co. Kgaa.
- TREEM, W. (nittonhundranittiofem). Medfödd lindy-isomaltasbrist. Journal of Pediatric Gastroenterology and Nutrition, tjugoett, 1-14.
- « Gastrinegenskaper, struktur, produktion, funktioner
- De 11 huvudtyperna av teknik och deras egenskaper »

