Diazoniumsalter

- 3889
- 964
- Anders Larsson
Vi förklarar vilka diazoniumsalter är, hur deras egenskaper och applikationer bildas
Vad är diazoniumsalter?
De Diazoniumsalter De är organiska föreningar där det finns joniska interaktioner mellan azo-gruppen (-N2+) Och en anjon x- (Cl-, F-, Ch3Kuttra-, etc.). Dess allmänna kemiska formel är RN2+X-, Och i detta kan sidokedjan R vara väl en alifatisk grupp eller en arylgrupp; det vill säga en aromatisk ring.
I den nedre bilden representeras strukturen för arenodiazoniumjonen. De blå sfärerna motsvarar azo -gruppen, medan svartvitt utgör den aromatiska ringen i fenylgruppen. Az+≡N).

Det finns emellertid resonansstrukturer som delokaliserar denna positiva belastning, till exempel i atomen av angränsande kväve: -n = n+. Detta härstammar när ett par elektroner som bildar länk riktas till kväveatomen till vänster.
På samma sätt kan denna positiva belastning demociera genom PI -systemet i den aromatiska ringen. Som en följd av detta är aromatiska diazoniumsalter mer stabila än alifatiska, eftersom den positiva belastningen inte kan demokera längs en kolkedja (CH3, Ch2Ch3, etc.).
Träning
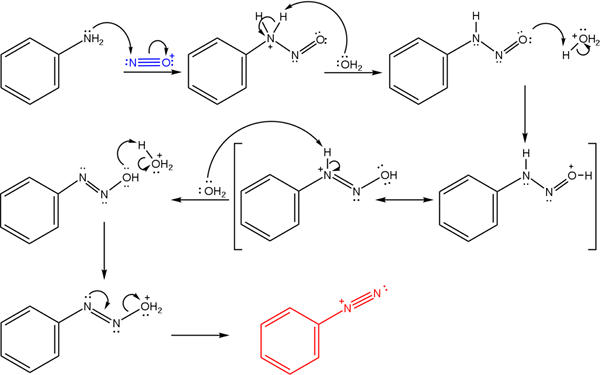
Dessa salter härstammar från reaktionen av en primär amina med en syrblandning av natriumnitrit (nano2).
Sekundära aminer (r2Nh) och tertiär (r3N) Andra kväveprodukter såsom N-nitrosoamin (som är gulaktiga oljor), aminsalter (R3Hn+X-) och N-nitrosoniumföreningar.
Den överlägsna bilden illustrerar mekanismen genom vilken bildningen av diazoniumsalter, eller även känd som diazotiseringsreaktion styrs.
Kan tjäna dig: Chrome (CR)Reaktionen börjar från fenylamin (AR-NH2), som utför en nukleofil attack på nitrosoniumkatjonen (nej+). Denna katjon produceras av Nano -blandningen2/Hx, där x vanligtvis är cl; det vill säga hcl.
Bildningen av nitrosoniumkationen frigör vatten i mitten, vilket rycker en positivt laddad kväveproton.
Sedan, samma vattenmolekyl (eller andra syraarter som skiljer sig från H3ANTINGEN+) ge en proton till syre, demokrerande den positiva belastningen i den mindre elektronegativa kväveatomen).
Nu är vattnet igen oskyddat till kväve och producerar sedan diazohydroxidmolekylen (antepenultimatet i sekvensen).
Eftersom mediet är surt lider diazohydroxiden uttorkning av OH -gruppen; För att motverka elektronisk vakans, det fria vridmomentet för trippelförbindelsen för Azo -gruppen.
På detta sätt förblir Bencenodiazoniumkloriden i slutet av mekanismen i lösning (c6H5N2+Kli-).
Egenskaper
I allmänhet är diazoniumsalter färglösa och kristallina, lösliga och stabila vid låga temperaturer (mindre än 5 ° C).
Vissa av dessa salter är så känsliga för mekanisk påverkan att alla fysiska manipulationer kan detonera dem. Slutligen reagerar de med vatten för att bilda fenoler.
Förskjutningsreaktioner
Diazoniumsalter är potentiellt molekylärt kväve, vars bildning är den gemensamma nämnaren för förskjutningsreaktioner. I dessa förskjuter en art X den instabila Azo -gruppen som flyr som N2(g).
Sandmeyer -reaktion
RNA2+ + Cucl => arcl + n2 + Cu+
RNA2+ + Cucn => arcn + n2 + Cu+
Gattermanreaktion
RNA2+ + Cux => arx + n2 + Cu+
Till skillnad från Sandmeyers reaktion har Gattermans reaktion metall koppar istället för sin halogenid; det vill säga CUX genereras In situ.
Schiemann -reaktion
[RNA2+] Bf4- => Arf + bf3 + N2
Kan tjäna dig: ketoner: typer, egenskaper, nomenklatur, användning, exempelSchiemanns reaktion kännetecknas av den termiska nedbrytningen av benszoniumfluorborat.
Gomberg Bachmann -reaktion
[RNA2+] Cl- + C6H6 => Ar - c6H5 + N2 + Hcl
Andra förskjutningar
RNA2+ + Ki => ari + k+ + N2
[RNA2+] Cl- + H3Po2 + H2O => c6H6 + N2 + H3Po3 + Hcl
RNA2+ + H2O => aroh + n2 + H+
RNA2+ + Stämpel2 => Arno2 + N2 + Cu+
Redoxreaktioner
Diazoniumsalter kan reduceras till arilhydraziner med hjälp av en blandning av CNCL2/Hcl:
RNA2+ => Arnhnh2
De kan också reduceras till arilaminer i starkare reduktioner med Zn/HCl:
RNA2+ => Rnah2 + Nh4Kli
Fotokemisk nedbrytning
[RNA2+] X- => Arx + n2
Diazoniumsalter är känsliga för att sönderdelas genom förekomst av ultraviolett strålning eller vid mycket nära våglängder.
Azokopplingsreaktioner
RNA2+ + Ar'h → RNA2Ar ' + h+
Dessa reaktioner är kanske de mest användbara och mångsidiga av diazoniumsalter. Dessa salter är svaga elektrofiler (ringen flyttar den positiva belastningen för Azo -gruppen). För att reagera med aromatiska föreningar måste de vara negativt laddade, vilket orsakar azosföreningar.
Reaktionen passerar med effektiv prestanda mellan ett pH på 5 och 7. I syra pH är kopplingen lägre eftersom azo -gruppprotonerna, vilket gör attacken av den negativa ringen omöjlig.
I grundläggande pH (större än 10) reagerar diazoniumsalt med OH- Att producera diazohydroxid, som är relativt inert.
Strukturer av denna typ av organiska föreningar har ett mycket stabilt konjugerat PI -system, vars elektroner absorberar och avger strålning i det synliga spektrumet.
Följaktligen kännetecknas azoföreningar av att vara färgglada. På grund av den här egenskapen har de också kallats azoiska färger.
Kan tjäna dig: molaritet: koncentration, enheter, beräkning, övningar
Den överlägsna bilden illustrerar konceptet med kopplingen med orange av metyl som ett exempel. I mitten av sin struktur kan Azo -gruppen observeras och tjäna som kontakten för de två aromatiska ringarna.
Vilka av de två ringarna var elektrofi i början av kopplingen? Den till höger, eftersom sulfonatgruppen (-SO3) Ta bort elektronisk ringdensitet, vilket gör den ännu mer elektrofil.
Ansökningar

En av dess mest kommersiella applikationer är produktion av färgämnen och pigment, som också täcker textilindustrin i tygbands. Dessa azoiska föreningar är förankrade till specifika molekylära platser i polymeren, döende av färger.
På grund av dess fotolitiska nedbrytning används den (mindre än tidigare) vid reproduktionen av dokument. Som? Pappersområdena som täcks av en speciell plast avlägsnas och sedan appliceras en grundläggande fenollösning, färgar bokstäverna eller designblått.
I organisk syntes används de som utgångspunkter för många aromatiska derivat.
Slutligen har de applikationer inom smarta material. I dessa är en yta (till exempel guld) kopplade, vilket gör att det kan ge ett kemiskt svar på yttre fysiska stimuli.

