Egenskaper, typer och funktionsval
- 3880
- 835
- PhD. Emil Svensson
De Selectinas De är en familj av glykoproteiner som utgörs av polypeptidkedjor, som erkänner specifika konformationer av sockerarter (kolhydrater), belägna på ytan av andra celler och binder till dem. Av denna anledning kallas de också vidhäftningsmolekyler.
Dessa vidhäftningsreceptorer är kända för sin bevarade struktur. De presenterar tre domäner och tre olika glykoproteiner. De kan uttryckas som ytmolekyler, förutom att de lagras eller fungerar som lösliga molekyler.
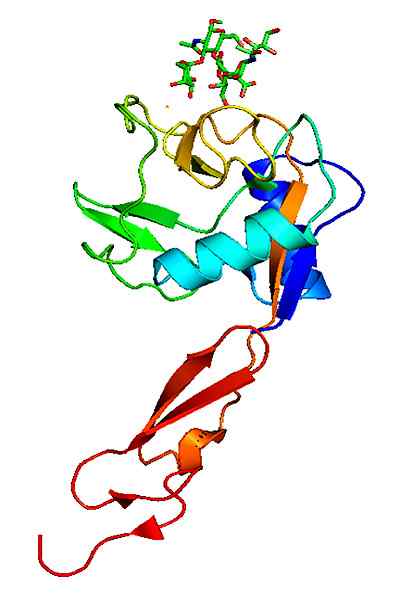
 Molekylstruktur av ett P-selektin. Tagen och redigerad från: Neveu, Curtis [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)].
Molekylstruktur av ett P-selektin. Tagen och redigerad från: Neveu, Curtis [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. I motsats till andra vidhäftningsmolekyler verkar Selectins endast i interaktioner mellan de vita blodkropparna med det vaskulära endotelet.
[TOC]
Egenskaper
Selectins är alla proteiner som innehåller kedje oligosackarider, förenade av kovalenta bindningar till laterala aminosyrakedjor (glykoproteiner). De är transmembranmolekyler, vilket innebär att de korsar lipiden bilay.
De delar egenskaper som mycket liknar CLEC eller Lectinas typ C -proteiner. Eftersom Selectins, som typ C -lektinas, kräver kalciumjoner för att utföra korsningen.
Ursprunget till ordet "Selectin" hänvisar till det faktum att dessa proteiner selektivt uttrycker i vaskulära systemceller och innehåller också en lektindomän.
Vissa författare inkluderar Selectins (glykoproteiner) inom lektinorna eftersom de är molekyler som binder till sockerarter. Men andra författare differentierar dem under konceptet att lektinor bara känner igen kolhydrater och går med i dem, medan Selectins inte bara känner igen och går med sockerarter, utan också bildas av kolhydrater.
Regleringen av Selectins sker på transkriptionell nivå, genom proteolytisk bearbetning, genom cellulär klassificering och genom reglerade uttryck för glykosil-transferaser.
Selectins har en kort intracellulär domän. De har emellertid tre extracellulära domäner, en domän av typen av epidermal tillväxtfaktor, en domän av lektintyp C och repetitionsenheter, liknande regleringsproteinerna för komplementet.
Kan tjäna dig: Hele -celler: Historia, egenskaper, cellcykel och användningarGrabbar
Selectin -familjen består av tre olika typer av glykoproteiner. Var och en av dessa identifieras med ett brev som betecknar platsen där de först identifierades. Nästa kommer vi att se var och en av dem.
L-selektin
Det är också känt som Sell, CD62L, LAM1, LEU8, LNHR, LSEL eller TQ1. Det finns i leukocyter, därmed "L" för Selectin. Det är en cellytkomponent. De tre domänerna är: en motsvarighet från lektinerna, en epidermal tillväxtfaktor och två upprepningsenheter.
Den presenterar flera ligander, det vill säga i allmänhet små molekyler som bildar komplex med en biomolekyl, i detta fall ett protein. De kända liganderna för L-selectin är följande.
Glykam1
Känd som molekylen -1 för cellulär vidhäftning beroende på glykosylering är det en proteoglykanligand som uttrycks i venösa inflammationer efter kapillär och gör det möjligt för lymfocyter att gå till blodomloppet mot lymfoida vävnader.
CD34
Det är ett fosfografoprotein, detekterat i flera grupper av däggdjur, såsom människa, råttor och möss, bland andra. Det beskrevs först i hematopoietiska stamceller. De finns i en mängd olika celler, men det är nästan uteslutande relaterat till hematopoietik.
Madcam-1
Känd som AD -harts eller celladhesionsmolekyl i riktning mot kärlslemhinnan (på engelska, vaskulär slemhinnan adressincelladhesionsmolekyl 1). Det är ett extracellulärt protein från endotelet som ansvarar för att bestämma i vilket vävnad lymfocyterna kommer att komma in, förutom att bära sockerarter så att de erkänns av L-selektinet.
PSGL-1
Känd bland andra synonymer som Selplg eller CD162, är det ett glykoprotein som finns i endotelceller och i leukocyter. Du kan gå med i de andra två typerna av Selectins. Det verkar dock som om det ger en bättre affinitet med p-selectin.
Kan tjäna dig: svampceller: egenskaper, organeller och funktionerP-selektin
P-selectin är känt av andra namn som SELP, CD62, CD62P, GMP140, GRMP eller LECAM3, bland andra. Det ligger på ytan av endotelcellerna, som täcker de inre marginalerna på blodkärl och blodplättar.
P-selectin identifierades för första gången på blodplättar. Det är därför namnet på proteinet bär den initiala "P".
Strukturen för P-selektinet består av en domän som är mycket lik typ C-lektinet vid N EGF-änden; Det vill säga en konserverad proteindomän av cirka 30 till 40 aminosyravfall, med ett två-katenära ß-blad följt av en slinga till en kortterminal bicatenary ß-terminal blad.
Den presenterar en tredje domning som liknar komplementprotein till komplement som kallas, såsom Cub -domänen, som kännetecknas av att vara en proteindomän som bevaras evolutionärt och genom att presentera cirka 110 aminosyravfall.
Liganden med större affinitet av p-selektinet är PSGL-1, som tidigare beskrivits i L-selectin-liganderna. Å andra sidan kan detta protein också bilda komplex med andra molekyler såsom sulfaterad polysackarid som kallas Fucoidan och heparán -sulfat.
E-selektin
Detta Selectin -protein är också känt med följande namn: Sele, CD62E, Elam, Elam1, EEL, LECAM2 och andra. Det uttrycks uteslutande i endotelceller som aktiveras av små proteiner som inte kan korsa lipid -tvåskiktet i cellen, kallad cytokiner.
Strukturen för detta protein består av 3 domäner (såsom resten av Selectins): en domän som liknar EGF, 6 enheter av kontrollproteinmoduler (även kallad sushidomäner) av upprepade SCR och en transmembrandomän.
Det kan tjäna dig: megacariocyter: egenskaper, struktur, bildning, mognad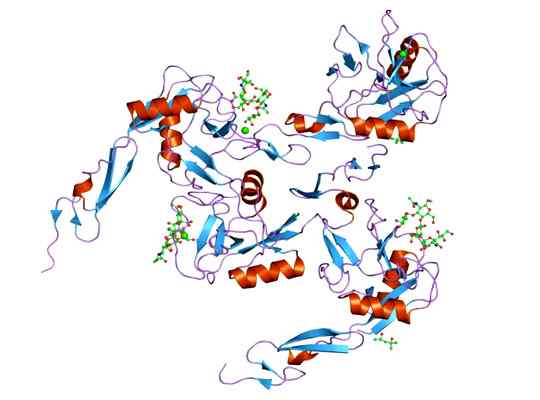 Representation av molekylstrukturen hos E-selectinproteinet, vars domino är EGF. Tagen och redigerad från: Jawahar Swaminathan och MSD -personal vid European Bioinformatics Institute [Public Domain].
Representation av molekylstrukturen hos E-selectinproteinet, vars domino är EGF. Tagen och redigerad från: Jawahar Swaminathan och MSD -personal vid European Bioinformatics Institute [Public Domain]. Liganden som bildar komplex med e-selektivet är ganska varierande, men de som sticker ut är följande.
Sialyl-Lewis a
Även kallad SLE A O CA19-9. Det är en tetrasakarid i sera hos cancerpatienter. Det är känt att delta i cellcelligenkänningsprocessen. Det uttrycks konstitutivt i granulocyter, monocyter och lymfocyter.
Sialyl-Lewis x
Det är också en tetratasakarid som Sialyl-Lewis A och har liknande funktioner. Det uttrycks i granulocyter och monocyter och kontrollerar den oönskade utgången eller läckaget av dessa celler under inflammation.
PSGL-1
Även om det tydligen är mer effektivt i P-selectin, anser vissa författare att formen härrörande från mänsklig neutrofil, också är ganska effektiv i E-selectin. I själva verket anser de att denna ligand i allmänhet är grundläggande för de tre typerna av Selectins.
Fungera
Selectins huvudfunktion är att vara en del av den vita blodkroppsprocessen (lymfocyter). De deltar också i immunsvaret, i kroniska och akuta inflammationer i olika organ i kroppen som njurar, hjärta och hud. De verkar till och med i de inflammatoriska processerna för cancerframkallande metastaser.
Referenser
- Selectin. Hämtad från: i.Wikipedia.org.
- L-selektin. Hämtad från: i.Wikipedia.org.
- CA19-9. Hämtad från: i.Wikipedia.org.
- E-selektin. Hämtad från: i.Wikipedia.org.
- X. Zou, v.R. Shinde Patil, n.M. Dagia, l.TILL. Smith, m.J. Wargo, k.TILL. Intergelgi, c.M. Lloyd, D.F. Tees, b. Walcheck, m.B. Lawrence, D.J. Goetz (2005). PSGL-1 härstammar från mänskliga neutrofiler är en högeffektiv ligand för Edothelium-Express E-selectin under flöde. American Journal of Physiology. Cellfysiologi.
- K. Law (2001). Selectins funktioner. Resultat och problem i celldifferentiering.
- Selectinas. Återhämtat sig från: wellpath.Uniovi.är.
- J.H. Pérez & C.J. Montoya. Vidhäftningsmolekyler. Hämtad från: Encolombia.com.
- TILL.C. Sanguineti & J.M Rodríguez-Tafur (1999). Vidhäftning och hudmolekyler. Peruansk dermatologi.
- T.F. Tedder, D.TILL. Brant, a. Chen, s. Engel (1995). Selectins: vaskulära vidhäftningsmolekyler. FASEB Journal.
- « Vita mangrove -funktioner, livsmiljöer, taxonomi, användningar
- Integrins egenskaper, struktur och funktioner »

