SGLT (natrium-glukostransportproteiner)
- 4364
- 167
- Hans Olsson
De Natrium-glukostransportproteiner (SGLT) De ansvarar för att utföra aktiv glukostransport i däggdjursceller mot en koncentrationsgradient. Den energi som krävs för att möjliggöra denna transport förvärvas från natriumkotransporten i samma riktning (SIMPORT).
Läget är begränsat till membranet i cellerna som bildar epitelvävnaderna som är ansvariga för absorption och reabsorption av näringsämnen (tunn tarm och den proximala konturerade tubuli i njurarna).
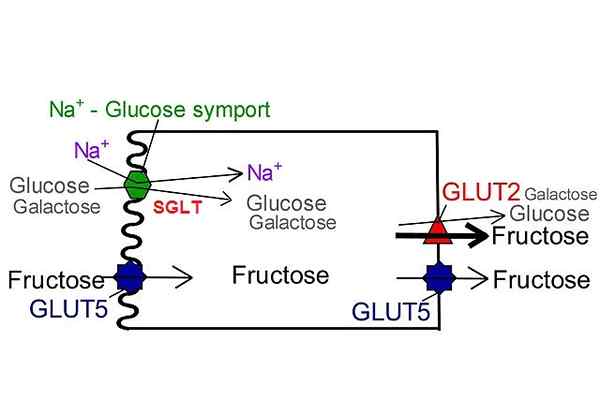
 SGLT -glukostransportörer till skillnad från GLUT. Av Nufs, San Jose State University [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)], modifierad av Wikimedia Commons.
SGLT -glukostransportörer till skillnad från GLUT. Av Nufs, San Jose State University [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)], modifierad av Wikimedia Commons. Hittills har endast sex isoformer som tillhör denna familj av transportörer beskrivits: SGLT-1, SGLT-2, SGLT-3, SGLT-4, SGLT-5 och SGLT-6. I dem alla ger den elektrokemiska strömmen som genereras genom transport av natriumjonen energi och inducerar den konformationella förändringen i strukturen för det nödvändiga proteinet för att translokera metaboliten på andra sidan membranet.
Men alla dessa isoformer skiljer sig från varandra genom att presentera skillnader i:
- Graden av affinitet de har för glukos,
- Förmågan att genomföra glukos-, galaktos- och aminosyratransport,
- I vilken grad de hämmas av Florizina och
- Vävnadsläget.
[TOC]
Molekylära mekanismer för glukostransport
Glukos är en monosackarid av sex kolatomer som används av de flesta befintliga celltyper för att erhålla energi genom metaboliska oxidationsvägar.
Med tanke på dess stora storlek och dess väsentligen hydrofilitiska natur kan den inte korsa cellmembranen genom fri diffusion. Därför beror dess cytosolmobilisering på närvaron av transportproteiner i dessa membran.
Glukostransportörer hittills studerat genomför transporten av denna metabolit genom passiva eller aktiva transportmekanismer. Passiv transport skiljer sig från aktiv transport där den inte kräver att en energiförsörjning genomförs, eftersom den inträffar till förmån för en koncentrationsgradient.
Det kan tjäna dig: Epidermis of the OnionProteinerna som är involverade i den passiva glukostransporten tillhör familjen av spridda spridningar av transportörer, således kallas av förkortningen på engelska av termen "glukostransportörer". Medan de som utför en aktiv transport av den har kallats SGLT med "natriumglukostransportproteiner".
Den senare får den nödvändiga fria energin för att genomföra transport av glukos mot dess koncentrationsgradient av natriumjonkotransport. Minst 6 SGR -isoformer har identifierats och dess plats verkar vara begränsad till epitelcellmembran.
SGLT -egenskaper
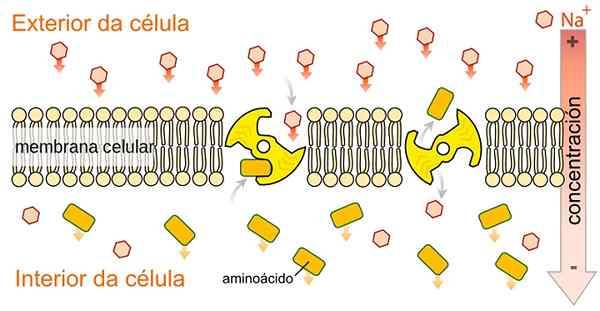 SLGT Simport -tränare är inte specifika för glukos, de kan transportera en annan variation av metaboliter såsom aminosyror, galaktos och andra metaboliter, eftersom de använder den energi som frigörs av natriumjonkotransport till förmån för deras koncentrationsgradient. Av speciladyofhats [cc0 (https: // creativecommons.Org/licenser/BY-SA/4.0), från Wikimedia Commons.
SLGT Simport -tränare är inte specifika för glukos, de kan transportera en annan variation av metaboliter såsom aminosyror, galaktos och andra metaboliter, eftersom de använder den energi som frigörs av natriumjonkotransport till förmån för deras koncentrationsgradient. Av speciladyofhats [cc0 (https: // creativecommons.Org/licenser/BY-SA/4.0), från Wikimedia Commons. Som anges i dess namn utför natriumglukostransportproteinerna Simport-typen av natrium och glukos eller natrium- och galaktos av cytosol till cellulär cytosol.
Natriumtransport till förmån för en koncentrationsgradient är ansvarig för att generera oumbärlig fri energi för att mobilisera glukos från en låg koncentrationszon till en hög koncentration.
Dessa transportörer är en del av en grupp anti -transport och sympatiprotein av natrium och väte vars gener inte är fylogenetiskt relaterade.
Läget är begränsat till luminalmembranet i epitelcellerna i vävnader involverade i absorptionen av näringsämnen, såsom tunna tarmen och den proximala konturerade tubuli.
Kan tjäna dig: coxiella burnetiiSGLT -typer
Hittills har sex SGLT-transportörer (SGLT-1, SGLT-2, SGLT-3, SGLT-4, SGLT-5 och SGLT-6) identifierats. Alla visar skillnader i preferensen för att transportera glukos eller galaktos, affiniteten de presenterar för dessa sockerarter och natrium och genom att kunna hämmas av Florizina.
SGLT1 har förmågan att transportera galaktos utöver glukos med en mycket liknande kinetik, medan SGLT2 endast transporterar glukos.
GSLT -struktur
Längden på peptidsekvensen för SGLT -proteiner sträcker sig från 596 till 681 aminosyravfall. Samtidigt varierar homologiprocenten mellan sekvenserna mellan 50 och 84 % i förhållande till SGLT-1, som är den största graden av divergens i sekvenserna som motsvarar den extracellulära domänen aminoterminal och terminal karboxyl.
Den allmänna strukturen sammanfaller med en multipaso -integrerad protein, det vill säga den korsar membranet flera gånger genom transmembrandomäner som är rika på hydrofoba aminosyror.
Dessa transmembrandomäner är totalt 14 och var och en av dem har en sekundär struktur a-helix. Segmenten 1, 2, 5, 7 och 9 är rumsligt organiserade i en central position som ger upphov till bildandet av hydrofil por.
Genom hydrofila portransiterar glukos, liksom någon av de andra metaboliterna för vilka transportören kan ha affinitet. De återstående spiralfragmenten är organiserade parallellt för att ge större strukturell stabilitet till kanalen.
SGLT -funktioner
SGLT -familjemedlemmar visar inte unik specificitet för glukos. Tvärtom, de kan aktivt mobilisera genom membranet av njurrörceller och tarmepitelet en mängd olika metaboliter såsom aminosyror, joner, glukos och osmolyter.
Funktionen för denna typ av transportörer som har studerats mer är reabsorptionen av glukosen som finns i urinen.
Det kan tjäna dig: Jämförande embryologi: Vad är det, vilka studier, historia, teorierDenna reabsorptionsprocess involverar mobilisering av kolhydrat från njurrör genom tubulära epitelceller till lumen hos peritubulära kapillärer. Att vara isoformen av hög kapacitet och affinitet för glukos SGLT-2, som är den viktigaste skattebetalaren.
Glukosabsorptionsfunktionen i tarmkanalen tillskrivs SGLT-1, en transportör som trots att den har låg kapacitet har en hög affinitet för glukos.
Den tredje medlemmen i denna familj, SGLT3, uttrycks i membranen av skelettmuskelceller och nervsystemet, där det inte verkar fungera som en glukostransportör utan som en sensor för koncentrationerna av detta socker i det extracellulära mediet.
Funktionerna för isoformer av SGLT4, SGLT5 och SGLT6 har inte varit säkra hittills hittills.
Referenser
- Abramson J, Wright EM. Struktur och funktion av NA -symporter med inverterade upprepningar. Curr ace struct biol. 2009; 19: 425-432.
- Alvarado F, Crane RK. Studier av mekanismen för tarmsabsorption av sockerarter. Vii. Fenylglykosidtransport och dess möjliga relation till phorizin -hämning av aktittransporten av SUG: er av det lilla Instest. Biochim Biophys Act. 1964; 93: 116-135.
- Charron FM, Blanchard MG, Lapointe JY. Intracellulär hypertonicitet ansvarar för vattenflödet associerat med Na_/Glycose Cotransport. Biophys J. 2006; 90: 3546-3554.
- Chen XZ, Coady MJ, Lapointe JY. Snabbspänningsklämningsdisker till en ny komponent av strömmar i perpaready-state från Na_-glukos cotransporter. Biophys J. Nitton nittiosex; 71: 2544-2552.
- Dyer J, Wood IS, Palejwala A, Ellis A, Shirazi-Beechey SP. Uttryck av monosackaridtransportörer i tarmen av diabetiska människor. Am J Physiol gastrointest leverfysiol. 2002; 282: G241-G248.
- Sátk M, Marks J, Unwin RJ. Förmodad vävnadsplats och funktion av SLC5 -familjemedlemmen SGLT3. Exp Physiol. 2017; 102 (1): 5-13.
- Turk E, Wright EM. Membran topologmotiv i SGG -cotransporter -familjen. J Memb Biol. 1997; 159: 1-20.
- Turk E, Kim O, Him J, Whitelegge JP, Eskandari S, Lam JT, Kreman M, Zampighi G, Faull KF, Wright EM. Molekylär karakterisering av Vibrio parahaemolyticus VSGLT: En modell för natriumkopplade socker cotransporters. J Biol Chem. 2000; 275: 25711-25716.
- Taroni C, Jones S, Thornton JM. Analys och förutsägelse av kolhydratbindningsställen. Eng -protein. 2000; 13: 89-98.
- Wright EM, Loo DD, Hirayama BA. Biologi av humana natriumglukostransportörer. Physiol rev. 2011; 91 (2): 733-794.

