Ammoniumsulfat
- 4483
- 1220
- Johan Eriksson
Vi förklarar vad som är ammoniumsulfat, dess kemiska struktur, fysiska och kemiska egenskaper och användningar
Vad är ammoniumsulfat?
han ammoniumsulfat Det är ett ternärt och ammoniak oorganiskt salt av svavelsyra. Dess kemiska formel är (NH4)2Sw4. Därför säger stökiometriska proportioner att för varje sulfatanjon finns det två ammoniumkatjoner som interagerar med honom. Detta tillåter saltneutralitet ((+1) ∙ 2 + (-2)).
Dess nomenklatur beror på att det är ett salt härrörande från h2Sw4, Ändra "Uric" -suffixet för "ATO". Således ersätts de två initiala protonerna av NH4+, Produkten av reaktionen med ammoniak (NH3). Så den kemiska ekvationen för dess syntes är: 2 nH3 + H2Sw4 => (NH4)2Sw4
Ammoniumsulfat framställs också genom reaktion av ammoniumkarbonat med kalciumsulfat: (NH4)2Co3 + Fall4 => (NH4)2Sw4 + Tjuv3, Utfällning av karbonatet i Calico, som är separerad från den återstående vätskan.
Ammoniumsulfat är kväve- och svavelförvaring, båda oumbärliga i markkemi och gödselmedel.
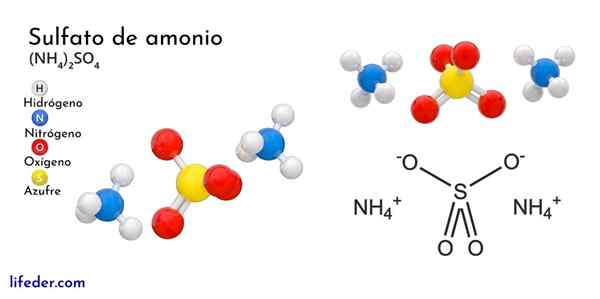
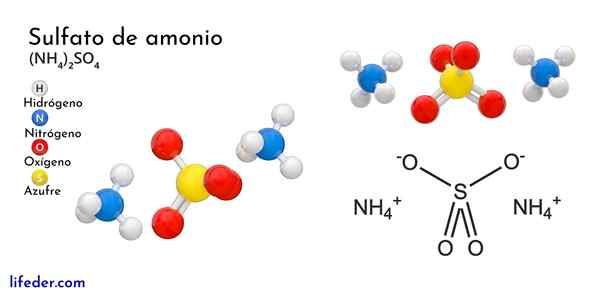
Kemisk struktur av ammoniumsulfat

Den överlägsna bilden illustrerar de molekylära geometrierna för NH -jonerna4+ Och så42-. De röda sfärerna motsvarar syreatomer, vita till väteatomer, blå till kväveatom och gult till svavelatom.
Båda jonerna kan betraktas som två tetrahedra, och har därmed tre enheter som interagerar för att bilda ett ortorrombiskt kristallint arrangemang. Sulfatanjonen är så42- Och det kan donera eller acceptera fyra vätebroar, liksom NH -katjonen4+.
Ammoniumsulfategenskaper
Molekylvikt
132,134 g/mol.
Det kan tjäna dig: Förhållande mellan kemi och teknik med människa, hälsa och miljöFysiskt utseende
Vit solid. Vita eller brun ortorrhrombiska kristaller, beroende på föroreningsnivåer.
Lukt
Toalett.
Smältpunkt
280 ºC. Denna smältpunkt, under andra joniska föreningar, beror på att det är ett salt med monovalenta katjoner (+1) och med förklädnadsjoner i dess storlekar, vilket får det fasta ämnet att ha låg kristallin retikulär energi.
Löslighet
76,4 g/100 g vatten vid 25 ° C. Denna affinitet för vatten beror på den stora kapaciteten hos deras molekyler att lösa ammoniumjonerna. Å andra sidan är den olöslig i aceton och alkohol; det vill säga i mindre polära lösningsmedel än vatten.
Densitet
1,77 g/cm3 vid 25 ºC.
Ångtryck
1 871 kPa vid 20 ºC.
Flashpoint
26 ºC.
pH
5,0 - 6,0 (25 ºC. Lösning 1 m). Något surt pH beror på NH -hydrolys4+ I vatten, producerar h3ANTINGEN+ vid låga koncentrationer.
Stabilitet
Stabilt i adekvata miljöförhållanden. I kontakt med starka oxidanter kan det sätta eld.
Sönderfall
Det börjar sönderdelas vid 150 ºC, frisläppande av toxiska svaveloxidångor, kväveoxid och ammonium.
Korrosion
Attackerar inte järn eller aluminium.
Användning av ammoniumsulfat
I jordbruket
- Ammoniumsulfat används som gödningsmedel i alkaliska jordar. Ammoniumsalt har 21 % kväve och 24 % svavel i sin sammansättning. Det finns emellertid föreningar som ger en mängd kväve större än ammoniumsulfat; Fördelen med den senare är dess höga svavelkoncentration.
- Svavel är viktigt i proteinsyntes, eftersom flera aminosyror - såsom cystin, metionin och cystein - har svavel. Av dessa skäl fortsätter ammoniumsulfat att vara en av de viktigaste gödselmedel.
- Det används i vete, majs, ris, bomull, potatis, hampa och fruktträd.
- PH av alkaliska jordar ner för deras bidrag i nitrifikationsprocessen som utförs av mikroberna. Ammonium används (NH4+) att producera nitrat (nej3-) och släpp h+: 2nh4+ + 4th2 => 2no3- + 2h2O + 4h+. Ökningen i vätekoncentrationen minskar pH för alkaliska jordar och möjliggör mer användning.
- Förutom dess användning som gödselmedel fungerar ammoniumsulfat som en adjuvans av lösliga insekticider, herbicider och fungicider, som sprayas på grödor.
- Sulfat kan kidnappar joner som finns i jorden och bevattningsvatten som är nödvändiga för livet för vissa patogener. Bland de joner som ammoniumsulfatet fångar är CA2+, Mg2+, tro2+ och tro3+. Denna åtgärd förbättrar den mikrobicida effekten av de ovannämnda medlen.
Som ett analytiskt reagens
Ammoniumsulfat fungerar som ett utfällningsmedel i elektrokemisk analys, mitt i mikrobiologisk kultur och i framställningen av ammoniumsalter.
I nederbörd och proteinisolering
Ammoniumsulfat används vid isolering och proteinrening, särskilt plasma. Till plasma tillsätts en mängd ammoniumsulfat för att ta det till en viss koncentration; Således orsakas nederbörden av en proteingrupp.
Fällningen genom centrifugering samlas in och supernatanten tillsätts en ytterligare mängd ammoniumsulfat och, till en ny koncentration, utfällningen av en annan grupp protein produceras.
Upprepningen av den tidigare processen möjliggör i följd att få olika plasmaproteinfraktioner.
Innan den nya tekniken för molekylärbiologi dyker upp tillät denna procedur isolering av plasmaproteiner av stor betydelse i medicin, till exempel: immunglobuliner, koagulationsfaktorer etc.
Inom industrin
Ammoniumsulfat verkar genom att försena eldstart i textilindustrin. Det används som ett tillsatsmedel i Electroenchapado -industrin. Det används också vid produktion av väteperoxid, ammoniumklorid, etc.
Andra användningsområden
- Ammoniumsulfat används som ett reglerande medel för osmotiskt tryck och som ett utfällningsmedel för salter.
- I form av ammoniumsulfat Lauril minskar det ytspänningen i vattnet, vilket möjliggör separering av föroreningar genom en ökning av vattenhårdheten.
- Är ett antikorrosivt medel.
- Det används som livsmedelstillsats som reglerar surhet i mjöldeg och bröd.
- « Mission och personlig visionkoncept, hur man gör dem, exempel
- Senare salter vad är, nomenklatur, egenskaper, exempel »