Kalciumsulfat (Case4) Kemisk struktur, egenskaper, användningar
- 3897
- 1117
- Anders Larsson
Vad är kalciumsulfat?
han kalsulfat Det är ett ternärt salt av kalcium, alkalinother metall (MR. Scholambara), svavel och syre. Dess kemiska formel är fall4, Vilket betyder att för varje katjon CA2+ det finns en anjon så42- interagerar med detta. Utgör en förening med bred distribution i naturen.
Dess vanligaste former är fallet4· 2h2Eller (gipset) och det vattenfria formen4 (Anhydriten). Det finns också en tredje form: gips eller gips i Paris, producerad genom uppvärmningen av gipsen (hemidratet, fallet4· 1/2h2ANTINGEN).
Kalciumsulfat är en mycket användbar förening i människans arbete, eftersom det används i många funktioner som inkluderar vägkonstruktion, hembörjande och till och med benreparation.
Kemisk struktur av kalciumsulfat

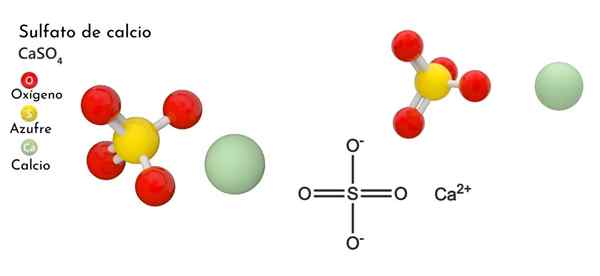
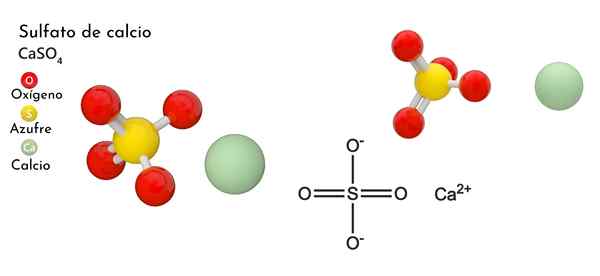
I den övre bilden visas den ortorrombiska enhetscellen för fallet4. Här antas att interaktioner är rent elektrostatiska; det vill säga att CA -katjoner2+ De lockar tetraedriska anjoner så42-.
Men CA2+ Det är mycket benäget att samordna och bilda polyhedrala strukturer runt den. För vad är det här? Till den elektroniska tillgängligheten av kalcium för att acceptera elektroner av grundläggande eller negativa arter (såsom atomerna i O SO42-).
Med tanke på föregående punkt, nu ca -jonerna2+ De accepterar dativa länkar (tillhandahålls av O) och enhetscellen omvandlas, vilket indikeras av den lägre bilden:
Följaktligen bildas Polyhedro Cao8 (Den gröna sfären i CA2+ omgiven av åtta röda sfärer av eller tetrahedra så4 stänga). Kalciumpolyhedros och sulfat tetrahedra; Detta är den kristallina strukturen i fallet4 vatten-.
Det kan tjäna dig: bipe beraral: vad är, egenskaper, vad är det förDessutom, när kristallerna är hydratiserade -formar det di -hydratiserade saltet eller hemidratet (fallet4· 1/2 h2O)- strukturen är försenad för att integrera vattenmolekyler.
Dessa molekyler kan isär och koordineras med kalcium; det vill säga de ersätter en eller två sulfatgrupper.
Å andra sidan fortsätter inte allt vatten att integrera Cao -polyhedronen8. Vissa, å andra sidan, bildar vätebroar med sulfater. Dessa fungerar som en förening för två sektioner i sicksack, produkter från arrangemanget av joner i glaset.
Kalciumsulfategenskaper
 Kalciumsulfatutseende
Kalciumsulfatutseende Molekylär formel
Case4 · NH2O.
Vattenfri molekylvikt
136,134 g/mol.
Lukt
Det är toalett.
Aspekt
När det gäller anhydrit ser det ut som ett vitt ortorrombiskt eller monokliniskt fast pulver. Kristallerna har en variabel färg: de kan vara vita eller med ett blå, gråaktigt eller rödaktigt färgämne; Det kan också vara tegelrött.
Densitet
2,96 gr/cm3 (vattenfri form). 2,32 GR/CM3 (Dihydratform).
Smältpunkt
1450 ºC (2840 ºF). Karakteristik för de starka elektrostatiska interaktioner mellan de tvåvärda jonerna CA2+ Och så42-.
Löslighet
0,2-0,3 % i vatten vid 25 ° C. Det är lite lösligt i vatten och olösligt i etanol.
Stabilitet
Stabil vid rumstemperatur.
Användning av kalciumsulfat
I konstruktion och konst
Det används vid utarbetandet av stuckaturen för att frisar väggarna i hemmen och andra konstruktioner som bidrar till dess förskönning. Dessutom tillverkas medieformar på tak och fönsterramar. Gipsen är också i rusningshimlen.
Kalciumsulfat används för att lösa problemet som uppstår vid hydrering av betong, vilket samarbetar i byggandet av vägar, vägar, etc.
Det kan tjäna dig: elektrofil: reaktioner, exempel, elektrofylitetMed gipsen utarbetas skulpturer, särskilt religiösa figurer, och på kyrkogårdarna används de i gravstenarna.
Terapeutik
Veterinär
Experimentellt har sterila kalciumsulfatstycken använts i veterinär för att reparera benfel eller hålrum, såsom de som lämnas av sår eller tumörer.
Gips eller Paris -gips kan användas för att reparera benfel för deras unika förmåga att stimulera osteogenes. X -Ray och Technecium Studies (TC99M) medronat.
En benregenerering har demonstrerats hos sex hundar under en period av 4 till 6 månader. Kalciumsulfat började användas inom detta fält 1957, i form av Paris gips tabletter, att kunna fylla i hundben.
Benersättning av kalciumsulfat är jämförbart med det som observerats i det autogena benet.
Ruhaimi (2001) applicerade kalciumsulfat i ett nyligen förstört kaninkäkben, observerar en ökning av osteogenes och benförkalkning.
Medicin
Kalciumsulfat används i medicin för att immobilisera lederna som har drabbats av dislokationer och i sprickade ben, förutom att de används som en hjälpämne i utarbetandet av tabletter.
odontologi
I tandvård används det som grund för att utarbeta tandproteserna, i restaureringar och intryck av tänderna.
I livsmedelsutarbetande
Det används som koagulant i utarbetandet av tofu, en mat som är tillverkad med soja och av stor konsumtion i östra länder som köttersättare. Dessutom har det använts som en matrefirmmedel och vid behandling av mjöl.
Kan tjäna dig: AlotropiSom gödningsmedel och balsam för grödor
Gipsen (fodralet4· 2h2O) Det användes som gödningsmedel i Europa sedan de 18.
Kalcium måste vara tillgängligt för växtrötter för adekvat utbud. Sedan förbättrar tillägget av kalcium trädgårds- och jordnötgrödor (jordnötter).
Rötter av jordnötsrötter producerade av biologiska patogener, liksom den apikala rötter av vattenmelon och tomat, kontrolleras delvis med jordbruksgipsnapplikationerna.
Gipset hjälper till att minska lerdispersionen och orsakar bildning av skabb på marken. Genom att minska skabb som bildas på marken underlättar gipsen utgången på plantorna. Det ökar också inledningen av luft och vatten till marken.
Gips hjälper till att förbättra jorden genom att mildra surheten och toxiciteten hos aluminium, och därmed anpassa grödan för natriumjord.
Vid produktion av andra föreningar
Kalciumsulfat reagerar med ammoniumbikarbonat för att bilda ammoniumsulfat. Det har också använts i produktionsprocessen för svavelsyran.
Ashidro kalciumsulfat blandas med skiffer eller mager och när blandningen värms upp, släpps svaveltrioxid. Svaveloxid är en svavelsyroregångare.