Kopparsulfat (CUSO4) struktur, egenskaper, erhållning, användning
- 3713
- 417
- Johan Gustafsson
han kopparsulfat Det är en oorganisk förening som bildas av koppar (Cu), svavel (er) och syre (O) (O). Dess kemiska formel är CUSO4. Kopparen är i ett tillstånd av oxidation +2, svavel +6 och syre har Valencia -2.
Det är ett vitt fast ämne att när den utsätts för miljöens fuktighet blir dess CUSO -blå pentahydrat4 •5 timmar2ANTINGEN. Det vita fasta ämnet erhålls genom att värma det blå för att eliminera vattnet.
 Kopparsulfat (Cuo4) vattenfri (utan vatten i dess kristallina struktur). W. Oelen/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/3.0). Källa: Wikimedia Commons.
Kopparsulfat (Cuo4) vattenfri (utan vatten i dess kristallina struktur). W. Oelen/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/3.0). Källa: Wikimedia Commons. Det har använts som ett antibakteriellt medel i århundraden för att läka sår hos människor och djur. Det fungerar också som en fungicid, som en sammandragande, antidiarré och kontrollerande tarmsjukdomar hos djur. Det används också som en antihongos -agent i växter.
Vissa av deras användningsområden har emellertid avbrutits eftersom deras överskott kan vara giftigt för både människor, djur och växter. Koncentrationsintervallet där det kan användas är smalt och beror på arten.
Det används som en katalysator i kemiska reaktioner och som lösningsmedel torkmedel. Det gör det möjligt att förbättra resistensen och flexibiliteten hos vissa polymerer.
Överdriven mängder av denna förening kan vara skadligt för jord, eftersom det är giftigt för mikroorganismer som är fördelaktiga för växter.
[TOC]
Strukturera
Kopparsulfat bildas av en kopparjon (CU2+) och en sulfatjon (så42-).
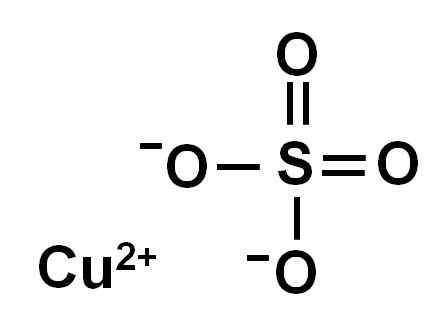 Ionica kopparsulfat (II). Författare: Marilú Stea.
Ionica kopparsulfat (II). Författare: Marilú Stea. På grund av förlusten av två elektroner har kopparjonen (ii) följande elektroniska konformation:
1s2 2s2 2 p6 3s2 3p6 3D9
Det kan ses att omloppet har 3D ofullständig (har 9 elektroner istället för 10).
Nomenklatur
- Vattenfri kopparsulfat
- Kopparsulfat (ii)
- Kuprisk sulfat
Egenskaper
Fysiskt tillstånd
Grönaktig vit fast eller kristallformad.
Molekylvikt
159.61 g/mol
Smältpunkt
Vid 560 ºC bryts det ner.
Densitet
3,60 g/cm3
Löslighet
22 g/100 g vatten vid 25 ° C. Olöslig i etanol.
Kemiska egenskaper
När den utsätts för luftens fukt under 30 ° C blir det cuso -pentahydratföreningen4 •5 timmar2ANTINGEN.
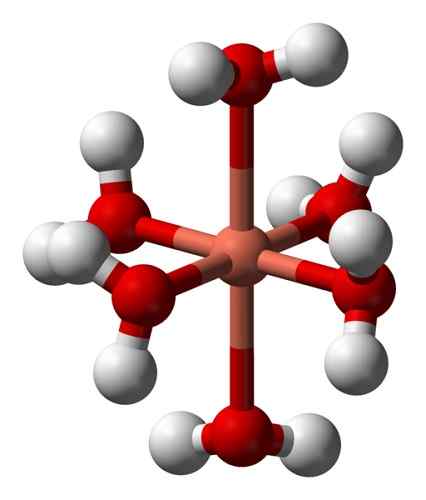
Dess vattenhaltiga lösningar är blå på grund av bildandet av den hexaacuocobre jonen (ii) [Cu (h2ANTINGEN)6]2+ som producerar sådan färg. I denna jon är två av vattenmolekylerna längre från den metalliska atomen än de andra fyra.
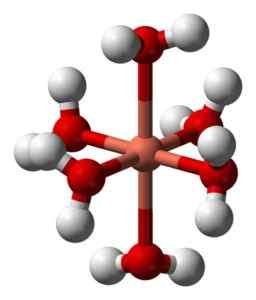 Deformerad struktur för hexaacuocobre -jonen (ii) [Cu (h2ANTINGEN)6]2+. Benjah-Bmm27 / allmän domän. Källa: Wikimedia Commons.
Deformerad struktur för hexaacuocobre -jonen (ii) [Cu (h2ANTINGEN)6]2+. Benjah-Bmm27 / allmän domän. Källa: Wikimedia Commons. Detta beror på den så kallade Jahn-Teller-effekten, som förutspår att denna typ av system upplever den snedvridning som orsakas av det faktum att CU2+ Den har en elektronisk struktur som slutar i D9, det vill säga en ofullständig orbital (den skulle vara klar om den var d10).
Kan tjäna dig: Kalciumhydroxid (CA (OH) 2): Struktur, egenskaper, erhållning, användningOm ammoniak läggs till (NH3) Dessa lösningar bildas där NH3 Vattenmolekyler förskjuts successivt. De bildas till exempel från [CU (NH3) (H2ANTINGEN)5]2+ Tills [CU (NH3)4(H2ANTINGEN)2]2+.
När Cuso4 Den värms upp till dess sönderdelning avger giftiga gaser och blir kopparoxid.
Erhållande
Vattenfri kopparsulfat kan erhållas genom total dehydrering av pentahydratföreningen, vilket uppnås genom att värma det tills vattenmolekylerna förångas.
Cuso4 •5 timmar2O + värme → Cuo4 + 5 h2Eller ↑
Pentahydratföreningen är blå, så CUSO -vattnet erhålls när man tappar kristallisationsvattnet4 Vita vatten-.
Ansökningar
Några av dess användningsområden överlappar varandra med Pentahydrate -föreningen. Andra är specifika för vattenfri substans.
Som antibakteriellt medel
Det har potential som ett antimikrobiellt medel. Det har använts i tusentals år, även i kulturer i Sydamerika och Centralamerika, för att förhindra sårinfektion genom gasväv impregnerad i en lösning av denna förening.
Det uppskattas att i mekanismen för dess antibakteriella aktivitet är jonerna Cu2+ De bildar kelater med enzymer som är avgörande för cellulära funktioner hos bakterier och inaktiverar dem. De inducerar också bildningen av hydroxylradikaler oh •, som skadar bakteriemembranen och deras DNA.
 Cuso4 Det kan arbeta mot vissa patogena bakterier. Författare: Gerd Altmann. Källa: Pixabay.
Cuso4 Det kan arbeta mot vissa patogena bakterier. Författare: Gerd Altmann. Källa: Pixabay. Nyligen har det rapporterats att Cuso spårar4 De kan öka den antimikrobiella aktiviteten hos naturliga produkter som är rika på polyfenoler, såsom granatextrakt och infusioner av vissa typer av teplanter.
I veterinärapplikationer
Det används som ett antiseptiskt och sammandragande för slemhinnor och för att behandla extern konjunktivit och otitis. Det tjänar till att utföra terapeutiska eller profylaktiska bad för att undvika råtta av nötkreatur, får och andra däggdjur.
 CUO Vattenlösningar4 De tjänar till att bota nötkreaturhål. Författare: Ingrid und Stefan Melichar. Källa: Pixabay.
CUO Vattenlösningar4 De tjänar till att bota nötkreaturhål. Författare: Ingrid und Stefan Melichar. Källa: Pixabay. Det fungerar som ett kaustiskt medel för nekrotiska massor i extremiteterna av nötkreatur, stomatit sår och granulerad vävnad av dessa. Det har använts som en fungicid i behandlingen av färgämne och sjukdomar orsakade av hudsvampar.
Det används också som en emético (agent för att provocera kräkningar) hos grisar, hundar och katter; som antidiarré Astringent för kalvar och för att kontrollera tarmmoniliasis i fjäderfä och kalkon trichomoniasis.
Som ett djurfodertillskott
Kopparsulfat har använts som ett tillskott i mycket små mängder för att mata nötkreatur, grisar och fjäderfä. Det tjänar till att behandla kopparbrist hos idisslare. När det gäller grisar och fåglar används det som en tillväxtstimulant.
Kan tjäna dig: kromatogramKoppar har identifierats som väsentlig för biosyntesen av hemoglobin hos däggdjur, hjärt -kärlstruktur, syntes av benkollagen, enzymsystem och reproduktion.
Som nämnts i föregående avsnitt kan det också levereras som medicinering för sjukdomskontroll. Emellertid måste tilläggs- och/eller medicineringsnivåer övervakas med försiktighet.
 Corral fåglar och deras ägg kan påverkas av ett överskott av kopparsulfat i sin diet. Författare: Pexels. Källa: Pixabay.
Corral fåglar och deras ägg kan påverkas av ett överskott av kopparsulfat i sin diet. Författare: Pexels. Källa: Pixabay. Från en viss mängd, som beror på varje art, kan en minskning av tillväxt, aptitförlust och vikt, skador på vissa organ och till och med djurens död kan uppstå.
Till exempel i kycklingar minskar tillskottet på 0,2% eller mer intag av mat av dessa med den därmed viktminskningen, minskad äggproduktion och tjockleken på deras skal.
I jordbruksapplikationer
I organiska produktionssystem är det inte tillåtet att använda syntetiska fungicider, endast koppar- och svavelprodukter accepteras, såsom kopparsulfat.
Till exempel vissa svampar som attackerar äppelväxter, till exempel Venturia inaequalis, elimineras med denna förening. Man tror att eventuella jonerna cu2+ De kan komma in i svampsporen, denaturalisera proteiner och blockera flera enzymer.
 Kopparsulfat tjänar till att bekämpa vissa svampar som attackerar äpplen. Algirdas på LT.Wikipedia / allmän domän. Källa: Wikimedia Commons.
Kopparsulfat tjänar till att bekämpa vissa svampar som attackerar äpplen. Algirdas på LT.Wikipedia / allmän domän. Källa: Wikimedia Commons. Kopparens betydelse i växter
Kopparelementet är viktigt i fysiologiska processer för växter som fotosyntes, andning och försvar mot antioxidanter. Både bristen på detta element och dess överskott genererar reaktiva syresatta arter som är skadliga för molekylerna och strukturerna hos dessa.
Kopparkoncentrationerna för optimal tillväxt och utveckling av växter är mycket smal.
Negativa effekter på jordbruket
När denna produkt används alltför i jordbruksaktiviteter kan den vara fytotoxisk, orsaka för tidig fruktutveckling och ändra sin färg.
Dessutom ackumuleras koppar på marken och är giftigt för mikroorganismer och daggmaskar. Detta strider mot begreppet organiskt jordbruk.
 Även om Cuso4 Det används i ekologiskt jordbruk kan vara skadligt för jordmaskar. Författare: Patricia Maine Degrave. Källa: Pixabay.
Även om Cuso4 Det används i ekologiskt jordbruk kan vara skadligt för jordmaskar. Författare: Patricia Maine Degrave. Källa: Pixabay. Vid kemiska reaktioner
Cuso4 Vattenfria fungerar som en katalysator för flera reaktioner av karbonylorganiska föreningar med dioler eller deras epoxider, bildar dioxolaner eller acetonider. Tack vare denna förening kan reaktionerna göras under mjuka förhållanden.
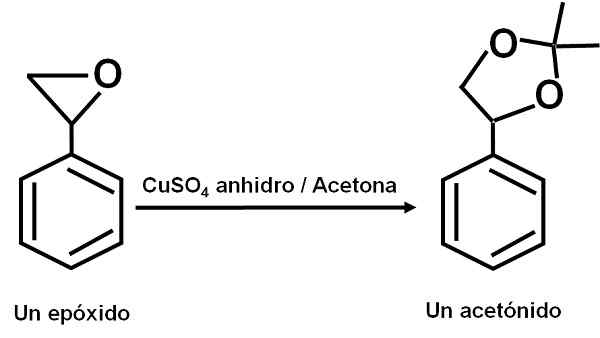 Exempel på reaktion där Cuso4 Vattenfria fungerar som en katalysator. Författare: Marilú Stea.
Exempel på reaktion där Cuso4 Vattenfria fungerar som en katalysator. Författare: Marilú Stea. Det har också rapporterats att dess katalytiska verkan gör det möjligt att dehydrera sekundära, tertiära, bensyl- och aliliska alkoholer till dess motsvarande olefiner. Reaktionen görs på ett mycket enkelt sätt.
Kan tjäna dig: anetolRen alkohol värms upp tillsammans med Cuso4 Vattenfri vid en temperatur av 100-160 ° C under en tid på 0,5-1,5 timmar. Således inträffar alkohol- och olefin -dehydrering, rena destillationer från reaktionsblandningen.
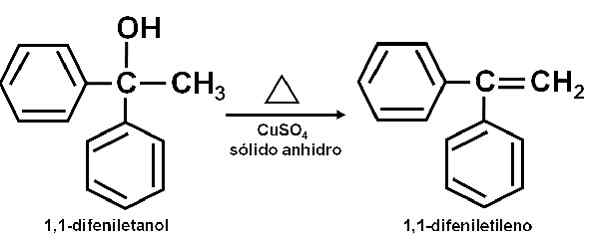 Uttorkning av en alkohol för kopparsulfat (ii) Vattenfri. Författare: Marilú Stea.
Uttorkning av en alkohol för kopparsulfat (ii) Vattenfri. Författare: Marilú Stea. Som ett dehydratiseringsmedel
Denna förening används i kemilaboratorier som torkmedel. Det tjänar till att dehydrera organiska vätskor som lösningsmedel. Absorbera vatten som bildar Cuo -pentahydratföreningen4 •5 timmar2ANTINGEN.
 När Cuso4 Vit anhydro absorberar vatten blir den blå pentahydratföreningen4.5 timmar2ANTINGEN. Crystal Titan/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/4.0). Källa: Wikimedia Commons.
När Cuso4 Vit anhydro absorberar vatten blir den blå pentahydratföreningen4.5 timmar2ANTINGEN. Crystal Titan/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/4.0). Källa: Wikimedia Commons. För att förbättra polymerer
Cuso4 Anhydro har använts för att förbättra egenskaperna hos vissa polymerer och samtidigt tillåta dem att återvinas.
Till exempel har partiklar av acetonföreningen blandats med akrylonitril-butadiengummi i ett speciellt kvarn och försöker göra CUSO-partiklar4 Vara mycket liten.
Kopparsulfat förbättrar polymerförbundets punkter som bildar en blandning med hög motstånd, hårdhet och överraskande flexibilitet.
I avbrutna terapeutiska tillämpningar
Tidigare användes kopparsulfatlösningar för gastrisk tvätt när någon drabbades av en vit fosforförgiftning. Lösningen rörde dock snabbt för att undvika kopparförgiftning.
Lösningarna på denna förening användes också tillsammans med andra ämnen för topiska brännskador i huden genom fosfor.
Ibland tjänade de i vissa former av näring.
Vissa lotioner för eksem, impetigo och intertrigo innehöll CUO4. Lösningar användes som ett sammandragande i ögoninfektioner. Ibland applicerades kristallerna direkt på brännskador eller sår.
Alla dessa applikationer görs inte längre på grund av toxiciteten som kan inducera överskott av förening.
Referenser
- ELLER.S. National Library of Medicine. (2019). Kopparsulfat. Återhämtat sig från pubchem.Ncbi.Nlm.Nih.Gov.
- Bly, D.R. (redaktör) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Montag, J. et al. (2006). En in vitro -studie på Venturia inaequalis. J. Jordbruks-. Matkeme. 2006, 54, 893-899. Länk återhämtat sig.Kandare.com.
- Holloway, a.C. et al. (2011). Förbättring av antimikrobiella aktiviteter av hela och subfraktionerat vitt te genom beroende av koppar (II) sulfat och C-vitamin mot Staphylococcus aureus; Till mekanistisk inställning. BMC Complement Altern Med 11, 115 (2011). Hämtad från BMCC -kompletteringsmederapier.biomedicin.com.
- Sanz, A. et al. (2018). Kopparupptagsmekanism av Thalian Arabidopsis Copt -transportörer med höghet. Protoplasma 256, 161-170 (2019). Länk återhämtat sig.Kandare.com.
- Griminger, s. (1977). Effekt av kopparsulfat på äggproduktion och skaltjocklek. Fjäderfävetenskap 56: 359-351, 1977. Återhämtat sig från akademiska.Orubb.com.
- Hanzlik, r.P. Och Leinwetter, m. (1978). Reaktion av epoxider och karbonylföreningar katalyserade av vattenfritt kopparsulfat. J. Org. Kem., Vul.43, nr.3, 1978. Återhämtat sig från pubar.ACS.org.
- Okonkwo, a.C. et al. (1979). Kopparbehov av babygrisar matade renad diet. Journal of Nutrition, Volym 109, nummer 6, juni 1979, sidorna 939-948. Återhämtat sig från akademiska.Orubb.com.
- Hoffman, r.V. et al. (1979). Vattenfri koppar (II) sulfat: en effektivitet. J. Org. Kem., 1980, 45, 917-919. Återhämtat sig från pubar.ACS.org.
- Shao, c. et al. (2018). Förbättrad draghållfasthet hos akrylonitril-butadiengummi/vattenfri kopparsulfatkompositer framställda genom koordination tvärbindning. Polym. Tjur. 76, 1435-1452 (2019). Länk återhämtat sig.Kandare.com.
- Betts, j.W. et al. (2018). Nya antibakteriella: Alternativ till traditionella antibiotika. Koppar. I framsteg inom mikrobiell fysiologi. Återhämtat sig från Scientedirect.com
- Bomull, f. Albert och Wilkinson, Geoffrey. (1980). Avancerad oorganisk kemi. Fjärde upplagan. John Wiley & Sons.
- Google -webbplatser. Göra vattenfri kopparsulfat. I Paradox Home Chemistry. Återhämtat sig från webbplatser.Google.com.
- « Regel t -funktioner, så att det tjänar, exempel
- Konstant (programmering) koncept, typer, exempel »

