Kopparsulfatpentahydratstruktur, egenskaper, användningar

- 4019
- 92
- Per Eriksson
han Pentahydratsulfat Det är en oorganisk förening som bildas av koppar (Cu), svavel (er), syre (O) och vatten (h2ANTINGEN). Innehåller kopparjoner (ii) (CU2+) och sulfat (så42-). Dess kemiska formel är CUSO4 •5 timmar2ANTINGEN.
I naturen bildar det Chalcantita eller Calcant Mineral, även kallad Chalclasa eller Calclasa. Det är ett blått kristallint fast ämne.
 Kopparsulfat Cuso kopparsulfat4 •5 timmar2ANTINGEN. Författare: überraschungsbilder. Källa: Wikimedia Commons.
Kopparsulfat Cuso kopparsulfat4 •5 timmar2ANTINGEN. Författare: überraschungsbilder. Källa: Wikimedia Commons. Det används som ett näringskomplement till vissa djur som idisslare, grisar och fjäderfä. I jordbruket fungerar det som bekämpningsmedel. I gruvaktiviteter gör det att återhämta andra metaller.
För sin blå nyans serverar färgning av tyger och metaller. Det har använts för att avsätta metall koppar på cellulosafibrer för att få elektricitetsledande tyger. Det används också för att framställa koppar -nanopartiklar och dess oxider, med en mängd olika tillämpningar.
I höga koncentrationer kan det vara giftigt för fauna och flora, så ibland används den för att eliminera skadedjur (djur eller växter) av vattenmiljöer som laguner och naturliga dammar.
[TOC]
Strukturera
Denna förening bildas av kopparelementet i dess oxidationstillstånd +2 och sulfatanjonen. Den senare har en svavelatom med Valencia +6 omgiven av fyra syreatomer, var och en med Valencia -2. På detta sätt har sulfatjonen två negativa laddningar.
Den har också 5 vattenmolekyler i sin struktur. I följande figur kan du se hur de olika atomerna i glaset är ordnade.
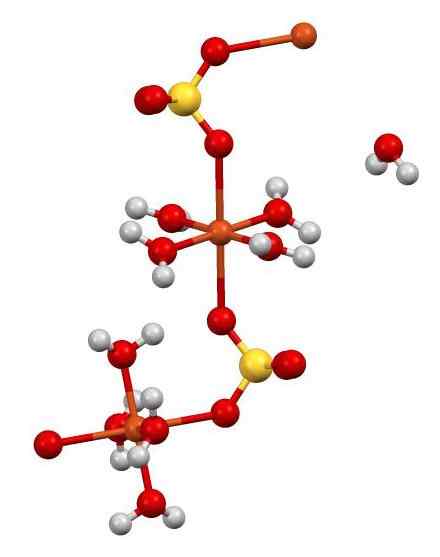 Cuo -struktur4 •5 timmar2ANTINGEN. Författare: Smokefoot. Källa: Wikimedia Commons.
Cuo -struktur4 •5 timmar2ANTINGEN. Författare: Smokefoot. Källa: Wikimedia Commons. CU2+ (Orange sfärer) samordnas samtidigt med 4 timmars molekyler2O (syre = rött; väte = vitt) och med 2 syreatomer i SOS42- (svavel = gul). I figuren en av H -molekylerna2O Det är i uppenbar frihet men är en del av den kristallina strukturen.
Nomenklatur
 Mineral från Chalcantita Cuso4 •5 timmar2ANTINGEN. Författare: Archaeodontosaurus. Källa: Wikimedia Commons.
Mineral från Chalcantita Cuso4 •5 timmar2ANTINGEN. Författare: Archaeodontosaurus. Källa: Wikimedia Commons. - Pentahydratsulfat
- Kopparlidande (ii) Pentahydrat
- Blåjack
- Blå sten (engelska Blå sten)
- Chalcantita, Calcantita, Chalclasa eller Calclasa
Egenskaper
Fysiskt tillstånd
Blå kristallint fast.
Molekylvikt
249,686 g/mol
Smältpunkt
När den når 110 ºC bryts det ner.
Densitet
2 286 g/cm3
Löslighet
Vattenlöslig: 22,0 g/100 g vatten vid 25 ° C. Metanollöslig (välj3ÅH). Något lösligt i etanol (välj3Ch2ÅH).
Kemiska egenskaper
Denna förening när man kommer i kontakt med vatten är upplöst och bildar jonerna Cu2+ Och så42-. Dess löslighet i vatten minskar avsevärt om svavelsyra finns i vatten.
Det kan tjäna dig: Kamphorös alkohol: Struktur, formel, egenskaper och användningarH2Sw4 Ger så joner42- Och dess närvaro genererar effekten av "vanlig jon", eftersom denna jon finns i pentahydratsulfat. Upplösning kan uttryckas enligt följande:
Cuso4 •5 timmar2Eller (fast) + vatten ⇔ cu2+ + Sw42- + vatten
Därför, om det redan finns i lösningen42- av svavelsyra, balans rör sig till vänster, det vill säga mot bildandet av det fasta ämnet och därmed minskar lösligheten.
Erhållande
Ett av sätten att erhålla pentahydrat kopparsulfat är att lösa malakitmineralet i vattenhaltig lösning av svavelsyra (h2Sw4) vid kontrollerad temperatur. Malquita innehåller CU2(ÅH)2Co3 Med andra föroreningar, till exempel järn.
Den orena lösningen av koppar (ii) behandlas med väteperoxid (h2ANTINGEN2) för att säkerställa att järnföroreningar (ii) (tro2+) bli järn (iii) (tro3+). Det senare är tillverkat i form av järnhydroxid (tro (OH)3) med natriumhydroxid (NaOH).
Utfällning innebär att partiklar av ett olösligt fast ämne bildas i lösningen, som faller till botten av behållaren som innehåller den.
 Utseende av en koncentrerad CUSO -lösning4 •5 timmar2ANTINGEN. Författare: Public DomainPartures. Källa: Pixabay.
Utseende av en koncentrerad CUSO -lösning4 •5 timmar2ANTINGEN. Författare: Public DomainPartures. Källa: Pixabay. Den resulterande blandningen filtreras för att avlägsna troens fasta (OH) (OH)3 Och den återstående vätskan behandlas med etanol (c2H5OH), metanol (välj3OH) eller svavelsyra för att fälla ut alla joner Cu2+ cuo4 •5 timmar2ANTINGEN.
När det till exempel tillsätter etanol finns det mindre vatten tillgängligt för CU -joner2+ Och så42- är i lösning och tenderar att gå ihop. Fungerar som en dehydratisering. Ju mer etanol den tillsätts mer solid.
Det utfällda fasta ämnet kan omkristas för att rena den. För att göra detta upplöses det i vatten vid en temperatur av 80-90 ° C och sedan svalnar lösningen vid 25-30 ° C. Pentahydratföreningen rusar igen och föroreningarna förblir i lösning.
Ansökningar
Har ett brett intervall av kommersiella applikationer.
Inom jordbruksområdet fungerar det som bekämpningsmedel, insektsmedel, herbicid, fungicid, groddmord och jord tillsats. I veterinärterapier används det som antihelmintic, fungicid och emético (för att orsaka kräkningar).
Det används som blått eller grönt pigment i färgämnen och färgämnen, som en mordant i färgen på tyger och metaller. Också som ett intryck toner i fotografier och som ett reagens för att intensifiera negativerna.
Kan tjäna dig: effektiv kärnbelastningDet används i gruvaktiviteter som ett flotationsreagens för zink och blyåtervinning. Det tjänar till att producera andra kopparföreningar, det används i solbränna.
I mat till djur
Denna förening används i dieten hos grisar i mycket små mängder som en promotor för tillväxt, särskilt i den bakre fasen. Mekanismen genom vilken den har denna effekt är fortfarande okänd.
Vissa forskare hävdar att det minskar befolkningen av patogena eller skadliga bakterier i tarmens tarm och följaktligen gynnar deras tillväxt.
 Med Cuso4 •5 timmar2O Du kan gynna utvecklingen av avvända grisar. Författare: Mabelamber. Källa: Pixabay.
Med Cuso4 •5 timmar2O Du kan gynna utvecklingen av avvända grisar. Författare: Mabelamber. Källa: Pixabay. Andra forskare indikerar att det förbättrar hälsan hos tarmen hos dessa djur, men vissa undersökningar indikerar att intravenös kopparinjektion också förbättrar dess tillväxt.
Det har också använts för samma syfte i fjäderfä och har använts i kopparbristen hos idisslare.
I nanopartikelsyntes
Pentahydrat kopparsulfat har använts för att erhålla blandade kopparnanopartiklar och kopparoxid (I) (CU/CU2ANTINGEN).
Nanopartiklar är extremt små strukturer som endast kan ses genom ett elektroniskt mikroskop.
Cu/cu -damm2O I form av nanopartiklar har den användning vid katalys eller acceleration av kemiska reaktioner, i halvledare och i antimikrobiella material, bland andra tillämpningar.
I studier för skadedjursbekämpning
Cuso4 •5 timmar2Eller det har använts i upplevelser för att utvärdera dess toxicitet gentemot arten av arten Pomacea canaliculata.
Dessa är infödda blötdjur i de tropiska regionerna i Sydamerika som bor i olika typer av ekosystem, från träsk och laguner till sjöar och floder.
De studeras eftersom vissa är värd för mänskliga parasiter som Schistosoma mansoni (Trematode som producerar sjukdomen i Bilharzia). Caracoles kan också vara skadliga för jordbruksgrödor i översvämmade regioner.
 Kaparazones de los caracoles Pomacea canaliculata. H. Zell/CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/3.0). Källa: Wikimedia Commons.
Kaparazones de los caracoles Pomacea canaliculata. H. Zell/CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/3.0). Källa: Wikimedia Commons.  Ägg avsatta av sniglarna i en vattenlevande växt. Dessa sniglar utgör ibland en pest som kan kontrolleras med CUSO4 •5 timmar2ANTINGEN. Shan LV, National Institute of Parasitic Diseases/CC av (https: // Creativecommons.Org/licenser/av/2.5). Källa: Wikimedia Commons.
Ägg avsatta av sniglarna i en vattenlevande växt. Dessa sniglar utgör ibland en pest som kan kontrolleras med CUSO4 •5 timmar2ANTINGEN. Shan LV, National Institute of Parasitic Diseases/CC av (https: // Creativecommons.Org/licenser/av/2.5). Källa: Wikimedia Commons. Enligt de granskade studierna är vattenhaltiga pentahydrat kopparsulfatlösningar extremt giftiga för dessa sniglar, så denna förening kan användas för att eliminera blötdjur från infekterade områden.
Kan tjäna dig: förbränningsreaktionerEnligt vissa undersökningar beror detta på att snigeln inte har något behov av kopparjonen, så bara kontakten med denna jon skulle vara tillräcklig för att djurets död ska inträffa.
I elektricitetsledande tyger
Denna förening har använts för att erhålla textilmaterial med integrerade elektricitetssensorer. Denna typ av tyg har applikation i elektricitetslagringsenheter, trycksensorer, fotodetektor och ljusutgivningsskärmar.
För att få elektricitetsledande tyger är en metallfiber av vävd cellulosacellulosa som kallas "Lyocell" täckt med metallisk koppar. Beläggningen utförs på ett icke -elektrolytiskt sätt baserat på en lösning av CUSO4 • 5H2O och andra hjälpkemiska föreningar.
 Lyocellfiber. Denna typ av tyg användes i kopparbeläggningstester. Dobrozhinetsky/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/3.0). Källa: Wikimedia Commons.
Lyocellfiber. Denna typ av tyg användes i kopparbeläggningstester. Dobrozhinetsky/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/3.0). Källa: Wikimedia Commons. Tyget som erhållits på detta sätt kan överföra en elektrisk signal även under deformationsförhållanden eller sträckning av hög konduktivitet.
Effekter på miljön
Som förklarats ovanför Cuso4 •5 timmar2Eller när upplösning i vatten genererar kopparjonen (ii).
Även om koppar är avgörande i låga koncentrationer för cellulära aktiviteter hos levande organismer, kan det i höga koncentrationer vara giftigt och till och med orsaka dödsfall.
Därför utgör närvaron av denna jon i miljön en risk för djur och växter. I vattenlevande ekosystem kan det vara bioacumulat i levande varelser och i livsmedelskedjan, vilket orsakar skador.
 Cuso4 •5 timmar2O Det kan vara skadligt för vattenmiljöer. Författare: Jamesdemers. Källa: Pixabay.
Cuso4 •5 timmar2O Det kan vara skadligt för vattenmiljöer. Författare: Jamesdemers. Källa: Pixabay. I vissa erfarenheter har det faktiskt visat sig att föroreningen av vattenmiljöer med pentahydratsulfat orsakar att biomassan för vissa vattenlevande växter minskar.
Vilket innebär att växter växer mindre i närvaro av detta salt i höga koncentrationer.
Referenser
- Bly, D.R. (redaktör) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Kokes, h. et al. (2014). Upplösning av koppar och järn från malakitmalm och precision av kopparsulfatpentahydrat genom kemisk process. Ingenjörsvetenskap och teknik, en internationell tidskrift. 2014; 17 (1): 39-44. Återhämtat sig från Scientedirect.com.
- Azevedo b alves., J.P. och peixoto, m.N. (2015). Biomassa reduktion av Irriterande Salvinia Utsatt för kopparsulfatpentahydrat (Cuo4.5 timmar2ANTINGEN). Varv. Omgivande. Vatten 2015; 10 (3): 520-529. Återhämtat sig från doaj.org.
- Rot, w. et al. (2019). Flexibel textilstamsensor baserad på kopparbelagd cellulosa-tyg av lyocellstyp. Polymerer 2019, 11, 784. MDPI återhämtade sig.com.
- Pitelli, r.TILL. et al. (2008). Akut toxicitet av kopparsulfat och vattenhaltigt extrakt av torkade neemblad på sniglar (Pomacea canaliculata). Sci Act. Biogus. Sci. 2008; 30 (2): 179-184. Återhämtat sig från doaj.org.
- BADAWY, S.M. et al. (2015). Syntes, karakterisering och katalytisk aktivitet av Cu/Cu2O -nanopartiklar framställda i vattenhaltigt medium. Bulletin of Chemical Reaction Engineering & Catalysis. 2015; 10 (2): 169-174. Återhämtat sig från doaj.org.
- Justel, f.J. et al (2014). Lösligheter och fysiska egenskaper hos mättade lösningar i kopparsulfat + svavelsyra + havsvattensystem vid olika temperaturer. Brasiliansk tidskrift för kemiteknik. 2015; 32 (3): 629-635. Återhämtat sig från doaj.org.
- Park, c.S. och Kim, b.G. (2016). In vitro Löslighet av koppar (II) sulfat och dikopperklorid trihydroxid för grisar. Asiatiska austalas. J. Anim. Sci. 2016; 29 (11): 1608-1615. Återhämtat sig från doaj.org.
- ELLER.S. National Library of Medicine. (2019). Kopparsulfatpennahydrat. Återhämtat sig från pubchem.Ncbi.Nlm.Nih.Gov.
- Wikipedia (2020). Kalkantit. Hämtas från.Wikipedia.org.
- « Marinbiomas egenskaper, typer, flora, fauna
- Vax (biologisk) struktur, egenskaper, funktion, typer »

